DEFINIZIONE
Il PVL può essere considerato una forma distinta di leucoplachia orale (OL) caratterizzata da lesioni multifocali, decorso clinico progressivo e cambiamenti nell’aspetto clinico e nelle caratteristiche istopatologiche. Tuttavia, la posizione di classificare il PVL come entità separata non è universalmente condivisa dal momento che non solo le LVP, ma anche le leucoplachie molto ampie e diffuse, comportano un rischio distinto di trasformazione maligna.
Nel 2020, il gruppo di lavoro del Centro Collaborativo per il Cancro Orale dell’OMS ha riconosciuto che “nonostante l’imperfezione del termine LVP per includere un gruppo esteso di pazienti con malattia multifocale, il termine è ampiamente affermato e il gruppo di lavoro ha raccomandato di mantenere questo termine”. Lo stesso gruppo ha proposto la seguente definizione: “un disordine progressivo, persistente e irreversibile caratterizzato dalla presenza di leucoplachie multiple che diventano frequentemente verrucose”.
Epidemiologia e rischio di evoluzione maligna
- La prevalenza complessiva della leucoplachia orale è stimata tra l’1,5% e il 2,6%. La LVP è meno comune della leucoplachia standard e i dati sulla sua prevalenza non sono disponibili.
- L’eziologia della LVP rimane sconosciuta.
- La leucoplachia verrucosa proliferativa è più comune nelle donne anziane senza una predilezione razziale e non è associato con i tradizionali fattori di rischio per leucoplachia orale e carcinoma squamocellulare orale (OSCC), come per esempio tabacco e consumo di alcol.
- Circa i due terzi dei casi di LVP sono nei non fumatori e nei pazienti che non segnalano l’abuso di alcol.
- La prevalenza riferita di HPV in LVP varia da 0-88% basata sui risultati di studi con piccoli campioni di pazienti.
- Uno studio sulla prevalenza dell’HPV in 58 pazienti non ha mostrato differenze significative tra i pazienti affetti da LVP e quelli con leucoplachia orale convenzionale (24% contro 25%)
- Al primo esame istopatologico, la maggior parte delle lesioni LVP (52,5%) mostrano ipercheratosi senza displasia o iperplasia verrucosa.
- Tuttavia, la LVP è associata ad una più alta incidenza di cancro orale (carcinoma verrucoso o carcinoma a cellule squamose) fra tutti i OPMD.
- Circa il 61% dei pazienti con LVP sviluppa un cancro orale in un periodo medio di 7,4 anni, anche se una recente revisione sistematica stima che la trasformazione maligna si verifica nel 49,5% (CI 26,7%-72,4%) dei casi di PVL (Spriano et al., 2020).
- L’incidenza annua è stimata al 10,0%.
- In letteratura, sono stati riportati casi di carcinomi primari multipli in pazienti affetti da LVP.
- La LVP è associata ad una mortalità complessiva del 40%.
Presentazione clinica
Clinicamente, la LVP può coinvolgere una singola grande area della mucosa orale, ma più frequentemente, è multifocale: colpisce la gengiva, la mucosa buccale e la lingua in siti contigui e non contigui della cavità orale. Le sedi orali più frequentemente coinvolte da LVP sono la gengiva (62,7%), la mucosa buccale (59,8%) e la lingua (49,1%). Le figure 1-4 illustrano la LVP che colpisce più siti all’interno della cavità orale.
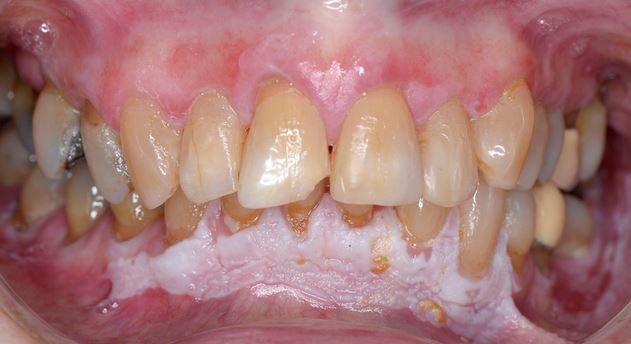
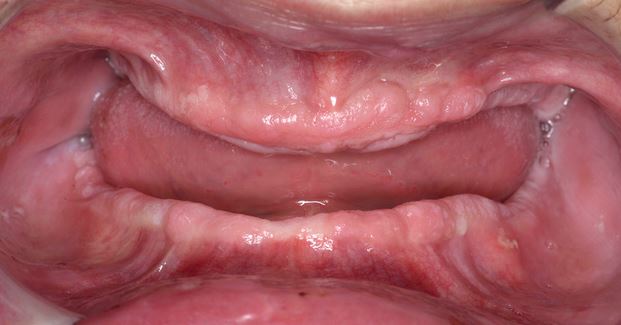
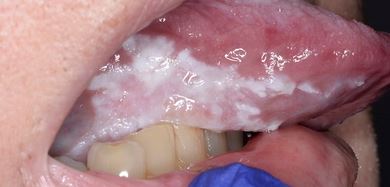
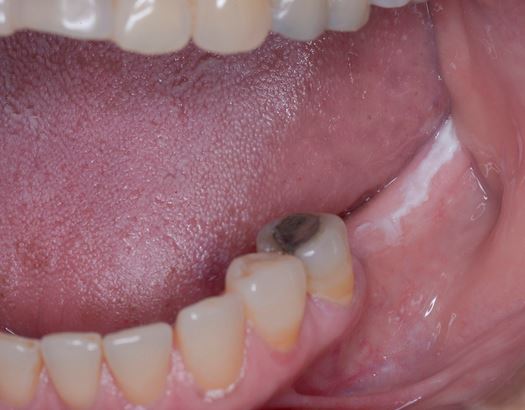
La multifocalità e il decorso clinico progressivo sono le caratteristiche primarie che caratterizzano la LVP. Le lesioni orali nella LVP sono spesso associate a cambiamenti nel quadro clinico e istopatologico. La tabella 1 riporta le caratteristiche cliniche della LVP descritte nella recente relazione sugli OPMD messa a punto dal Centro di collaborazione dell’OMS per il cancro orale.
| Presentazione clinica della leucoplachia verrucosa proliferativa |
| Macchie multiple, spesse, bianche in più di due diverse sedi orali che si localizzano spesso sulla gengiva, creste alveolari e il palato. |
| La maggior parte della lesione presenta un aspetto verrucoso |
| Le lesioni si espandono e si uniscono durante lo sviluppo |
| Ricorrenza in un’area precedentemente trattata |
Tabella 1: Presentazione clinica della LVP secondo il Centro di collaborazione dell’OMS per il cancro orale 2020 [4].
La LVP origina solitamente come leucoplachia omogenea senza displasia all’esame istologico e evolve progressivamente in lesioni verrucose in un’area singola o multipla della mucosa orale. All’inizio, la LVP si manifesta come una o più leucoplachie che interessano progressivamente siti multipli con la graduale espansione di una lesione singola o di più lesioni vicine [3,4]. Nelle fasi iniziali, la LVP può presentarsi come una lesione multifocale priva del tipico aspetto verrucoso. Inoltre, la lesione iniziale può essere bianca e piana, talvolta presentando un aspetto lichenoide, rendendo difficile la distinzione tra essa e il lichene planus orale (OLP) [3,4,28,29]. In tali casi, la LVP può essere erroneamente trattato come OLP per lunghi periodi con il conseguente rischio di perdere o ritardare la diagnosi di un potenziale OSCC.
La LVP è caratterizzato anche da eritema evidente (19% nello studio di Villa et al) con un tasso di trasformazione maligna (MTR) del 100% rispetto a quelle lesioni senza una componente eritematosa (MTR 62,5%).
Diagnosi
- Le caratteristiche istopatologiche di LVP non sono patognomoniche e non sono specifiche: vanno dall’ipercheratosi nelle fasi iniziali, all’iperplasia verrucosa e a diversi gradi di displasia.
- Inoltre, i casi di LVP caratterizzati clinicamente da una componente infiammatoria o da un aspetto lichenoide possono mostrare all’esame istopatologico una banda linfocitaria “lichenoide” ed essere erroneamente diagnosticate come lichen planus orale.
- Per questo motivo, la diagnosi definitiva della leucoplachia verrucosa proliferativa viene effettuata sulla base di una combinazione di risultati clinici e istopatologici.
- Ogni lesione bianca che diventa verrucosa ed esofitica, con diffusione nel tempo e recidiva dopo il trattamento, deve essere considerata come LVP.
Dalla prima definizione nel 1985, altri autori hanno proposto criteri diagnostici alternativi. Nel 2010, Cerero-Lapiedra et al hanno proposto cinque criteri principali e quattro criteri minori e combinazioni specifiche di essi per stabilire una diagnosi precoce di LVP (Tab.2).
| Criteri principali | Criteri minori |
| Leucoplachia orale che colpisce più di due diverse sedi orali (più frequentemente gengiva, palato e cresta alveolare) | Le lesioni hanno un’estensione che supera i 3 cm (sommando tutte le aree interessate) |
| Aspetto clinico verrucoso | Genere femminile |
| Le lesioni mostrano progressione ed estensione clinica | Non fumatore (indipendentemente dal sesso) |
| Ricorrenza in un’area precedentemente trattata | Evoluzione della malattia più lunga di 5 anni |
| Quadro istopatologico di ipercheratosi epiteliale orale o iperplasia verrucosa, carcinoma verrucoso o carcinoma a cellule squamose. | . |
La diagnosi di LVP può essere fatta quando sussistono:
tre criteri principali (di cui uno istopatologico)
o due principali (di cui uno istopatologico) e due criteri minori
Tabella 2: Criteri diagnostici LVP secondo Cicero-Lapiedra et al. (Modificato da [3,20]).
Carrard et al ha proposto di semplificare i criteri diagnostici della LVP omettendo la distinzione tra criteri principali e criteri minori e ha suggerito che dovrebbero essere soddisfatti almeno quattro criteri (tabella 3).
| Criteri diagnostici per LVP modificati: tutti e quattro i criteri devono essere soddisfatti. |
| Leucoplachia che mostra la presenza di aree verrucose o simil-verrucose che coinvolgono più di due siti orali. Si riconoscono i seguenti siti orali: dorso della lingua (unilaterale o bilaterale), bordo della lingua, mucosa delle guance, mucosa alveolare o gengiva superiore della mascella, mucosa alveolare o gengiva inferiore, palato duro e molle, pavimento della bocca, labbro superiore e labbro inferiore. |
| Sommando tutti i siti coinvolti, la dimensione minima dovrebbe essere di almeno tre centimetri. |
| Un periodo ben documentato di evoluzione della malattia di almeno cinque anni, caratterizzato dalla diffusione e dall’espansione delle lesioni e dal verificarsi di una o più recidive in un’area precedentemente trattata. |
| La disponibilità di almeno una biopsia al fine di escludere la presenza di un carcinoma verrucoso o carcinoma a cellule squamose |
Tabella 3: Criteri diagnostici semplificati per LVP.
- In presenza di una lesione sospetta di LVP o di leucoplachia non omogenea, è importante scegliere le parti più rappresentative quando si effettua una biopsia per evitare una sotto-stima diagnostica.
- L’esame istopatologico può presentare diagnosi variabili all’interno della stessa lesione. Per questo motivo, le biopsie multiple di mappatura sono spesso raccomandate. N ella leucoplachia verrucosa proliferativa sono indicate biopsie multiple e periodiche per rilevare diversi gradi di displasia o per escludere OSCC.
- È stato riportato che circa il 10% -17% dei casi di OSCC può non essere diagnosticato eseguendo una singola biopsia nelle LVP e leucoplachie non omogeneo.
Gestione
- La gestione e il trattamento delle LVP sono particolarmente impegnativi. Nell’ultimo decennio, sono stati proposti diversi approcci per ridurre l’alta incidenza di cancro orale tra i pazienti affetti da LVP.
- Ad oggi, nessuno dei trattamenti (chirurgia, ablazione laser, retinoidi, terapia fotodinamica e chemioterapia) ha dimostrato di essere efficace nel ridurre lo sviluppo del cancro orale in questi pazienti.
- Nonostante la mancanza di studi clinici sull’efficacia, il trattamento chirurgico è l’intervento più frequentemente adottato nella gestione delle LVP.
- Quando la leucoplachia verrucosa proliferativa è caratterizzata da piccole lesioni e se l’area è confinata, l’escissione può essere tentata, ma il paziente deve essere consapevole che il follow-up sarà necessario a causa dell’elevato rischio di cancro orale e del rischio di recidiva della lesione (71%).
- La maggior parte dei casi di LVP presentono lesioni di grandi dimensioni che coinvolgono aree multifocali non contigue.
- Una recente revisione sistematica ha riportato che il tasso complessivo di recidiva della LVP è di circa l’85% per tutte le modalità di trattamento, senza alcuna riduzione dell’incidenza di cancro.
- Per tutti questi motivi, l’escissione chirurgica della leucoplachia verrucosa proliferativa può essere considerata un’opzione di trattamento aggressiva, poco funzionale e necessaria.
- Molti clinici scelgono un approccio “wait and see”, basato su biopsie multiple periodiche e visite clinici regolari.
- L’obiettivo di questo approccio è quello di identificare l’insorgenza molto precoce del carcinoma orale, offrendo così il migliore risultato terapeutico e una buona prognosi.
In conclusione, considerando l’elevata incidenza di cancro nei pazienti affetti da LVP, è obbligatorio effettuare biopsie multiple e un rigoroso follow-up clinico (ogni 3-6 mesi a seconda delle caratteristiche cliniche). La tempistica della trasformazione maligna è imprevedibile, quindi è necessario un follow-up per tutta la vita.
Riferimenti e ulteriori letture
1. Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, 60, 285–298, doi:10.1016/0030-4220(85)90313-5.
2. Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9, 122, doi:10.1186/1477-7819-9-122.
3. Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760, doi:10.1111/odi.12830.
4. Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
5. Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
6. van der Waal, I. Oral leukoplakia; a proposal for simplification and consistency of the clinical classification and terminology. Med. Oral Patol. Oral y Cir. Bucal 2019, 24, e799–e803, doi:10.4317/medoral.23372.
7. Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003, 39, 770–780, doi:10.1016/S1368-8375(03)00102-7.
8. Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
9. Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental practitioners. Br. Dent. J. 2017, 223, 655–661, doi:10.1038/sj.bdj.2017.881.
10. Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2021, 27, 919–923, doi:10.1111/odi.13622.
11. Bagan, J. V.; Jimenez, Y.; Murillo, J.; Gavaldá, C.; Poveda, R.; Scully, C.; Alberola, T.M.; Torres-Puente, M.; Pérez-Alonso, M. Lack of Association Between Proliferative Verrucous Leukoplakia and Human Papillomavirus Infection. J. Oral Maxillofac. Surg. 2007, 65, 46–49, doi:10.1016/j.joms.2005.12.066.
12. Palefsky, J.M.; Silverman, S.; Abdel‐Salaam, M.; Daniels, T.E.; Greenspan, J.S. Association between proliferative verrucous leukoplakia and infection with human papillomavirus type 16. J. Oral Pathol. Med. 1995, 24, 193–197, doi:10.1111/j.1600-0714.1995.tb01165.x.
13. Campisi, G.; Giovannelli, L.; Ammatuna, P.; Capra, G.; Colella, G.; Di Liberto, C.; Gandolfo, S.; Pentenero, M.; Carrozzo, M.; Serpico, R.; et al. Proliferative verrucous vs conventional leukoplakia: No significantly increased risk of HPV infection. Oral Oncol. 2004, 40, 835–840, doi:10.1016/j.oraloncology.2004.02.007.
14. Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
15. Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
16. Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
17. Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
18. Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2021, 115, 105121, doi:10.1016/j.oraloncology.2020.105121.
19. Capella, D.L.; Gonçalves, J.M.; Abrantes, A.A.A.; Grando, L.J.; Daniel, F.I. Proliferative verrucous leukoplakia: diagnosis, management and current advances. Braz. J. Otorhinolaryngol. 2017, 83, 585–593, doi:10.1016/j.bjorl.2016.12.005.
20. Cerero-Lapiedra, R.; Balade-Martinez, D.; Moreno-Lopez, L.; Esparza-Gomez, G.; Bagan, J. Proliferative verrucous leukoplakia: A proposal for diagnostic criteria. Med. Oral Patol. Oral y Cir. Bucal 2010, 15, e839–e845, doi:10.4317/medoral.15.e839.
21. Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
22. Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
23. Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
24. Abadie, W.M.; Partington, E.J.; Fowler, C.B.; Schmalbach, C.E. Optimal Management of Proliferative Verrucous Leukoplakia: A Systematic Review of the Literature. Otolaryngol. – Head Neck Surg. (United States) 2015, 153, 504–511, doi:10.1177/0194599815586779.
25. Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
26. Ghazali, N.; Bakri, M.M.; Zain, R.B. Aggressive, multifocal oral verrucous leukoplakia: proliferative verrucous leukoplakia or not? J. Oral Pathol. Med. 2003, 32, 383–392, doi:10.1034/j.1600-0714.2003.00180.x.
27. Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
28. Garcia-Pola, M.; Llorente-Pendas, S.; Gonzalez-Garcia, M.; Garcia-Martin, J. The development of proliferative verrucous leukoplakia in oral lichen planus. A preliminary study. Med. Oral Patol. Oral y Cir. Bucal 2016, 21, e328–e334, doi:10.4317/medoral.20832.
29. McParland, H.; Warnakulasuriya, S. Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J. Oral Pathol. Med. 2021, 50, 229–235, doi:10.1111/jop.13129.
30. Carrard, V.C.; Brouns, E.R.E.A.; van der Waal, I. Proliferative verrucous leukoplakia; A critical appraisal of the diagnostic criteria. Med. Oral Patol. Oral Cir. Bucal 2013, 18, e411–e413, doi:10.4317/medoral.18912.
31. Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, 104550, doi:10.1016/j.oraloncology.2019.104550.
32. Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
33. Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
34. Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; MacDonald, L.C.; Worthington, H. V.; Mauleffinch, L.F. Limited evidence for interventions to treat oral leukoplakia. Evid. Based. Dent. 2017, 18, 92–93.
35. Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.







