Lichen Planus orale e lesioni lichenoidi orali
Il lichen planus orale (OLP) e le lesioni lichenoidi orali (OLL) includono un gruppo di disturbi della mucosa orale che probabilmente rappresentano un modello di reazioni comuni in risposta ad antigeni estrinseci, autoantigeni alterati e superantigeni.
Storicamente, ci sono stati dibattiti e controversie, ancora irrisolte, riguardo alla terminologia di OLP e OLL, e mancano ancora criteri diagnostici clinici e istologici definitivi per differenziare OLP dagli OLL. Inoltre, non vi è consenso sulle possibili differenze cliniche e comportamentali per quanto riguarda il rischio di trasformazione maligna tra OLP e OLL.
L’OLP è stato incluso come disturbo potenzialmente maligno nella classificazione del 2005 ed è stato recentemente confermato nel seminario di collaborazione del Centro di collaborazione dell’Organizzazione mondiale della sanità per il cancro orale tenutosi nel Regno Unito nel 2020.
Oral Lichen Planus
L’OLP è stato definito come “un disturbo infiammatorio cronico di eziologia sconosciuta con ricadute e remissioni caratteristiche, che mostra lesioni reticolari bianche, accompagnate o meno da aree atrofiche, erosive e ulcerative e/o di tipo a placca”. Le lesioni sono spesso bilateralmente simmetriche. La gengivite desquamativa può essere una caratteristica.
Prevalenza:
- Prevalenza stimata dell’1–3% della popolazione. L’OLP è la malattia mucocutanea più comune del cavo orale.
- Preferenza per il sesso femminile
- Aumento del rischio di sviluppo dopo i 40 anni di età, con un’età media di presentazione di 50-55 anni.
Trasformazione maligna:
In un’analisi che includeva esclusivamente quelle pubblicazioni che soddisfacevano severi criteri di qualità, gli autori hanno osservato un tasso di trasformazione maligna del 2,28% per OLP.
Fattori di rischio:
- Localizzazione linguale
- presenza di lesioni atrofiche/erosive
- consumo di alcohol e tabacco
- Papillomavirus umano
- Visu dell’epatite C (HCV)
- presenza di aneuploidia
Il rischio massimo di sviluppare un cancro orale è compreso tra 3 e 6 anni dopo la prima diagnosi di OLP.
I pazienti con OLP e OLL possono sviluppare lesioni maligne multiple, che non sempre si sviluppano nella sede di lesioni preesistenti. L’OSCC che si sviluppa nei pazienti con OLP e OLLs mostra parametri prognostici favorevoli, soprattutto in termini di tasso di mortalità.
Presentazione clinica:
Le caratteristiche cliniche distintive dell’OLP sono rappresentate dalla presenza di papule bianche che si allargano e si fondono a formare un pattern reticolare, anulare o simile a una placca, le cosiddette strie di Wickham.
- Sono stati descritti classicamente 6 sottotipi clinici di OLP, che possono essere osservati singolarmente o in combinazione: reticolare, a placca, atrofica, erosivo/ulcerativo, papulare e bolloso. Discutiamo di 2 sottotipi (cheratotico/bianco ed eritematoso/rosso).
- Di solito si presenta con lesioni di più di un sottotipo contemporaneamente
- Le sedi più comunemente colpite sono la mucosa buccale, il laterale e il dorso della lingua e la gengiva
- Quasi sempre una distribuzione bilaterale, più o meno simmetrica
- Il decorso dell’OLP è caratterizzato da ricadute e remissioni, con intervalli di diverse settimane o mesi, sia dei segni clinici che dei sintomi.
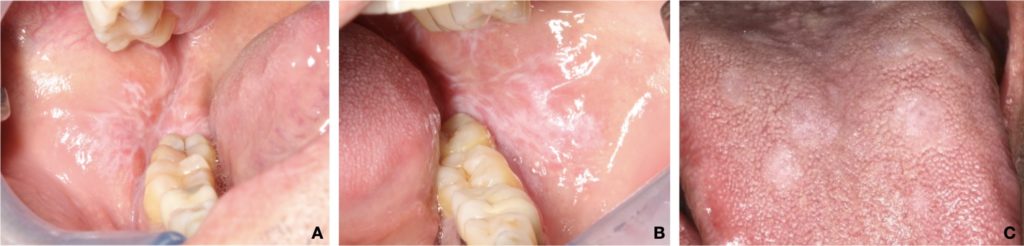
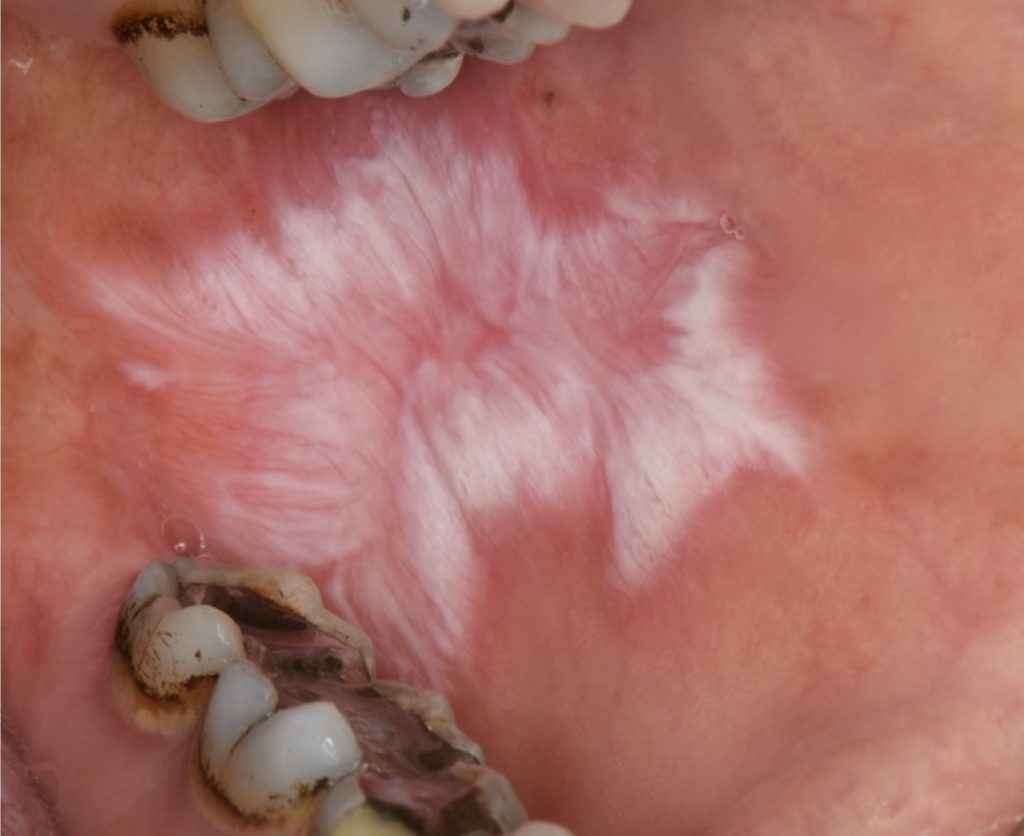
Planus del lichene orale cheratotico/bianco:
- La forma più riconosciuta di OLP, caratterizzata da lesioni reticolari bianche simmetriche (strie di Wickham) e meno frequentemente da papule o placche bianche (Fig. 1).
- La forma della placca dell’OLP appare come una placca bianca multifocale omogenea, leggermente rialzata, che colpisce tipicamente la lingua e la mucosa buccale (Fig. 2c).
- Generalmente asintomatico – di solito un reperto accidentale durante l’esame di routine della cavità orale da parte dei dentisti.
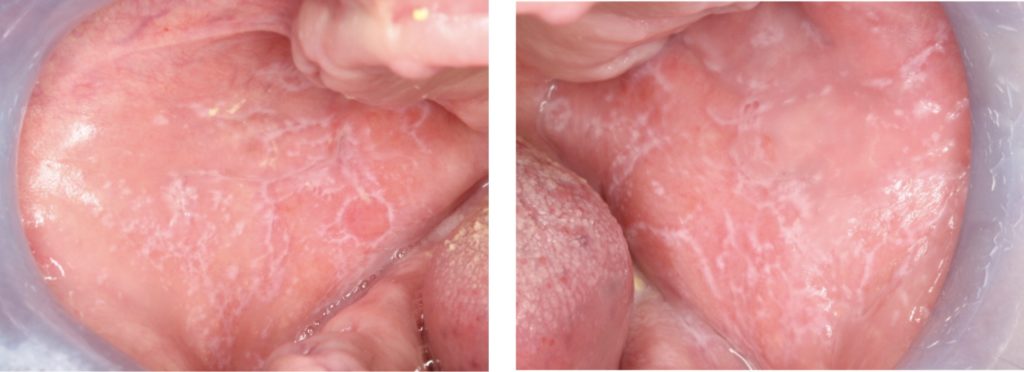
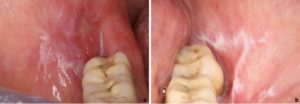
Lichen planus orale eritematoso/rosso:
- Può presentarsi come un’area di mucosa atrofica o come lesioni rosse dovute a iperemia della mucosa orale.
- Aree di eritema possono essere accompagnate da ulcerazione e sono spesso associate a strie cheratosiche bianche (Fig. 4).
- Varietà di sintomi, da una lieve sensazione di bruciore a un dolore debilitante. Le lesioni possono interferire con la parola, la masticazione e la deglutizione.
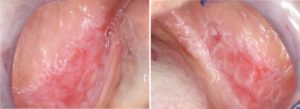
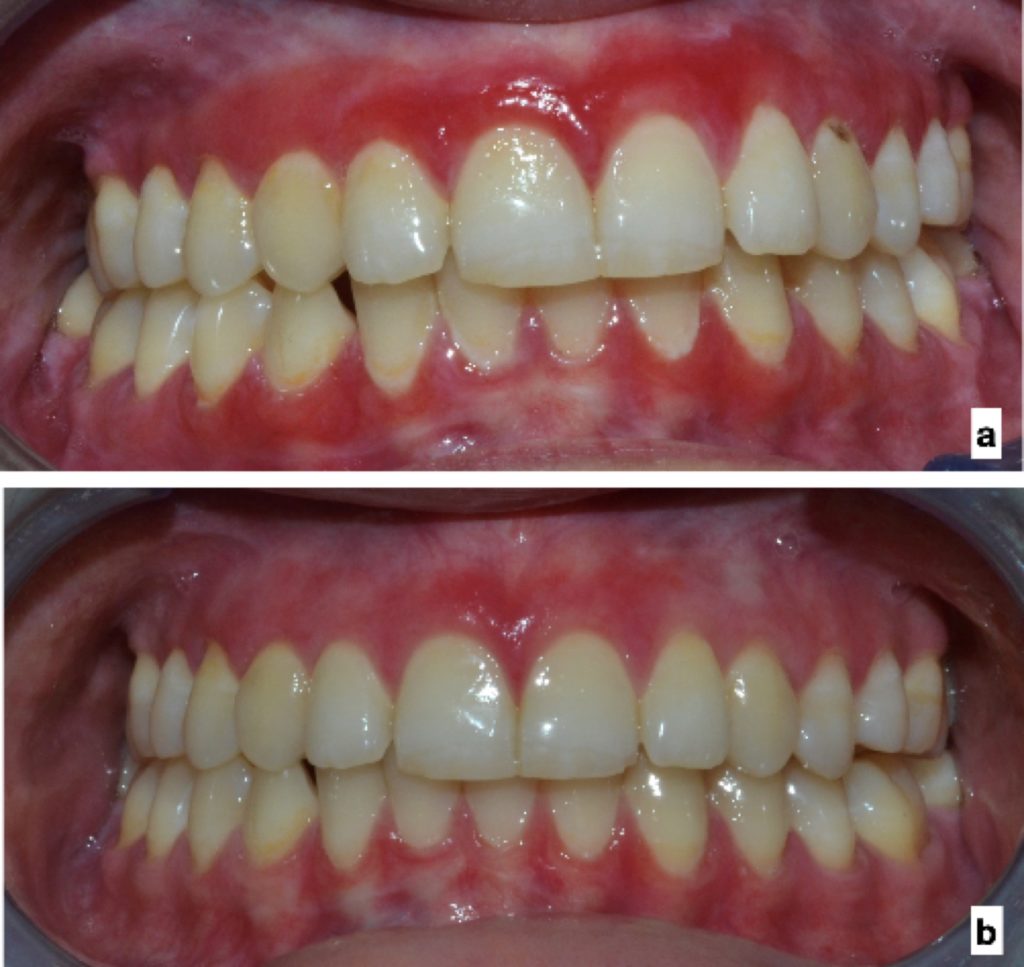
Gengivite desquamativa:
- Il lichen planus erosivo localizzato sulle gengive si presenta come gengivite desquamativa (Fig. 6).
- L’OLP è la causa più comune di gengivite desquamativa, seguita da pemfigoide e pemfigo (23).
- La gengiva buccale è più comunemente colpita.
Manifestazioni extraorali:
- Il 15% dei pazienti con OLP sviluppa lichen planus cutaneo, fino al 60% dei pazienti con lichen planus cutaneo ha manifestazioni orali
- Si presenta come un rash papulosquamoso con protuberanze violacee, piatte, di varia grandezza, spesso descritte utilizzando le “6 P” (viola, pruriginose, poligonali, planari, papule e placche), caratterizzate dal classico strie Wickham
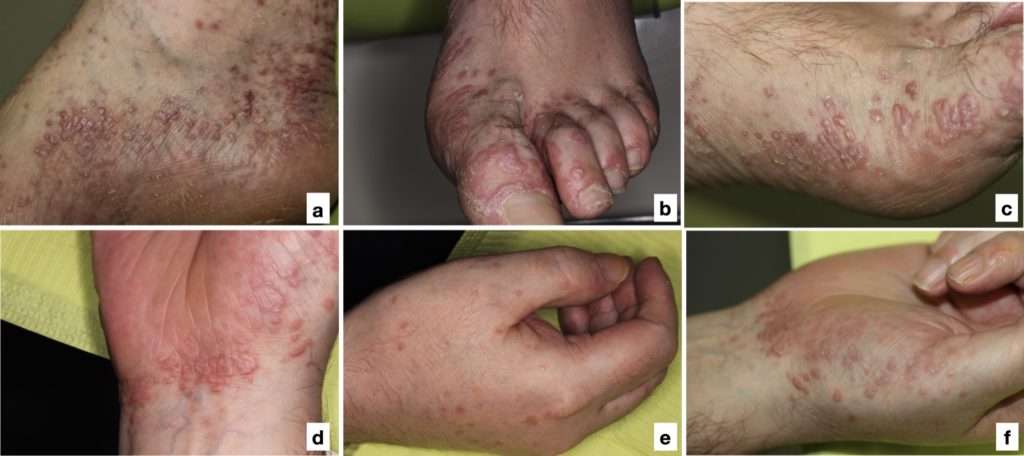
- Tipicamente localizzato sulle estremità (Fig. 7) ma occasionalmente si presenta con interessamento generalizzato e può comprendere cuoio capelluto e unghie.
- Altre sedi anatomiche che possono essere interessate sono la mucosa genitale, l’esofago, la mucosa oculare, urinaria, nasale, laringea, otica, gastrica e anale.
Associazione con Malattie Sistemiche:
L’OLP è associato a varie malattie sistemiche, tra cui epatite C, ipertensione, diabete e malattie della tiroide
Forte prove che l’HCV è associato all’OLP ed è probabilmente coinvolto nella sua patogenesi. Sarebbe prudente chiedere ai pazienti con OLP i fattori di rischio associati all’HCV e, se interessati, richiedere la determinazione degli anticorpi dell’HCV.
Diagnosi differenziali:
- Lesioni reticolari ed eritematose: OLLs e lupus eritematoso discoide
- Forme atrofiche e ulcerative: pemfigo volgare, pemfigoide e immunoglobuline di linea (Ig)-A (differenziate per reticolazione).
- Forma della placca: leucoplasia orale, leucoplachia verrucosa proliferativa (PVL)
Indipendentemente dalla loro diagnosi iniziale, questi pazienti con lesioni multifocali bianche devono essere attentamente monitorati per la trasformazione maligna precoce.
Diagnosi:
- Implica la valutazione dell’aspetto clinico
- Devono essere eseguiti studi bioptici e patologici per confermare la diagnosi a causa della necessità di un trattamento a lungo termine e del rischio di trasformazione maligna
| Tipo | Risultati |
| Criteri Clinici | Presenza di lesioni bianche bilaterali, più o meno simmetriche, a carico della mucosa buccale, della lingua, delle labbra e/o della gengiva. Presenza di lesioni papulari bianche e una rete a pizzo di linee bianche leggermente in rilievo (modello reticolare, anulare o lineare) con o senza erosioni e ulcerazioni. A volte si presenta come gengivite desquamativa. |
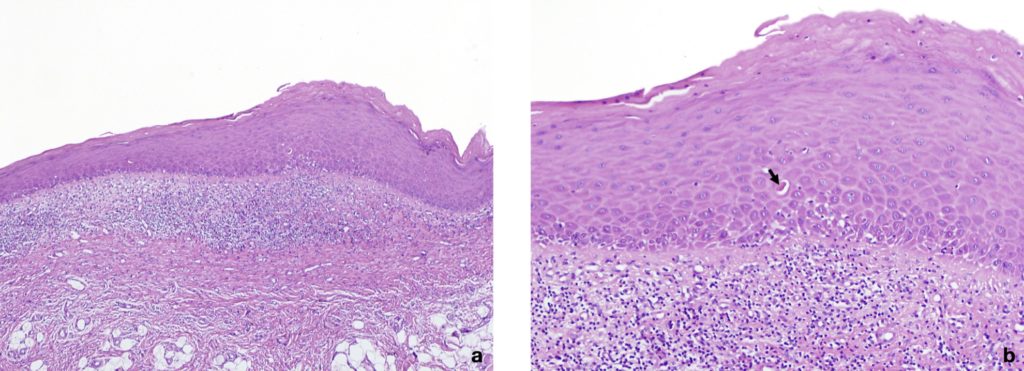
| Criteri istopatologici | Presenza di un ben definito infiltrato a fascia prevalentemente linfocitaria confinato alla parte superficiale del tessuto connettivo. Segni di degenerazione vacuolare degli strati cellulari basali e/o soprabasali con apoptosi dei cheratinociti. Nel tipo atrofico, c’è un assottigliamento epiteliale e talvolta un’ulcerazione causata dalla mancata rigenerazione epiteliale a causa della distruzione delle cellule basali. Si può trovare un infiltrato infiammatorio misto. |
Tabella 1: criteri diagnostici per il lichen planus orale (adattato da Warnakulasuriya et al., 2020)
Gestione:
- L’obiettivo principale del trattamento con OLP è il sollievo dei sintomi: i pazienti con lesioni reticolari e altre lesioni asintomatiche non necessitano di trattamento.
- In primo luogo, devono essere identificati ed esclusi i fattori scatenanti e aggravanti (denti affilati o rotti, protesi mal adattata, ecc.).
- I pazienti devono essere informati di interrompere il consumo di tabacco e alcol perché possono aumentare il rischio di trasformazione maligna I pazienti devono anche essere istruiti a mantenere una buona igiene orale, poiché la riduzione della placca dentale può avere un effetto benefico sulle lesioni gengivali.
- Il sodio-lauril solfato (SLS) è un agente schiumogeno aggiunto ai dentifrici che può esacerbare i sintomi e possono essere utilizzati preferibilmente dentifrici privi di SLS.
- Il sollievo sintomatico può essere ottenuto utilizzando agenti anestetici topici come la benzidamina cloridrato 0,15% (come spray o collutorio) o gel di lidocaina.
- I corticosteroidi topici sono gli agenti di prima linea per il trattamento dell’OLP. Sono disponibili numerosi preparati da utilizzare come collutori: Betametasone sodio fosfato 500 microgrammi compresse disciolte in 10 ml di acqua fino a quattro volte al giorno, prednisolone 5 mg compresse disciolte in 10 ml di acqua o Flixonase 400 mcg nasule aggiunte a 10 ml di acqua due volte al giorno. Lo spray fluticasone propionato (50 microgrammi/puff) diretto alle aree interessate 3-4 volte al giorno è utile per lesioni isolate.
- Per le gengiviti desquamative si utilizzano preparazioni con corticosteroidi sotto forma di gel applicati in mascherine personalizzate individuali, realizzate in resina morbida trasparente o silicone per aumentare il tempo di contatto.
Follow-up
- A causa del rischio di trasformazione maligna, dovrebbe essere condotto un follow-up regolare per valutare la ricaduta.
- La frequenza delle visite di follow-up aumenta proporzionalmente all’attività e ai sintomi della malattia.
- Come minimo, la raccomandazione è un follow-up annuale e preferibilmente da 2 a 4 controlli annuali basati sui segni e sintomi di OLP.
- Se si osservano cambiamenti in una lesione durante le visite di follow-up, deve essere eseguita una biopsia e gli intervalli di follow-up devono essere ridotti.
Lesioni lichenoidi orali
Le lesioni lichenoidi sono lesioni intraorali rosso/bianche con un aspetto striato reticolare simile all’OLP ma sono associate a diversi stimoli noti. Le lesioni possono essere suddivise in lesioni da contatto lichenoidi orali (OLCL), OLL indotte da farmaci e OLL indotte da GVHD.
Lesioni da contatto lichenoidi orali:
- OLCL è usato per descrivere lesioni orali che assomigliano al lichen planus, sia clinicamente sia istopatologicamente.
- Si ritiene che sia causato da una reazione di ipersensibilità localizzata (ipersensibilità mediata da un’immunità ritardata) a un materiale da restauro dentale (amalgama, oro, nichel, resina acrilica) o altri agenti di contatto (ad es. cannella).
- Presenti come lesioni bianche o lesioni miste rosso/bianche, occasionalmente ulcerate. Gli OLCL sono generalmente meno simmetrici e più spesso unilaterali dell’OLP e possono mancare del tipico aspetto reticolare dell’OLP, presentandosi più tipicamente nella placca o nella forma atrofica.
- La caratteristica diagnostica è la posizione topografica direttamente correlata al sospetto agente causale.
» Show more
- La durata del contatto tra l’agente causale e la mucosa orale sembra essere un fattore importante nello sviluppo di OLCL
- La diagnosi si basa solitamente sui risultati clinici e la scomparsa della lesione dopo l’eliminazione/sostituzione del materiale da restauro o di un possibile agente causale stabilisce la diagnosi.
- Può eseguire un patch test per identificare potenziali reazioni di ipersensibilità; tuttavia, gli studi sulla sua utilità per la diagnosi di OLCL hanno mostrato risultati contrastanti. L’esecuzione di un patch test può anche essere di aiuto per determinare il materiale da restauro alternativo.
- I medici dovrebbero discutere con i pazienti i potenziali benefici e rischi della rimozione dei restauri in amalgama, descrivendo la natura ciclica della malattia, caratterizzata da periodi di esacerbazione e remissione spontanea, e l’imprevedibilità della procedura di rimozione dell’amalgama per la risoluzione delle lesioni
» View less
Lesioni lichenoidi orali indotte da farmaci:
- Causati o associati all’esposizione a particolari farmaci e sono rari, a differenza degli OLL cutanei
- Esiste un lungo elenco di farmaci sistemici associati all’insorgenza di OLL, che comprende farmaci antinfiammatori non steroidei, antipertensivi, ipoglicemizzanti orali, antibiotici, antimicotici e anticorpi monoclonali
- Solitamente un’associazione temporale tra l’insorgenza di lesioni orali e/o cutanee e l’assunzione di determinati farmaci; tuttavia, la reazione al farmaco può verificarsi in qualsiasi momento, anche anni dopo la sua introduzione
» Show more
- L’aspetto clinico non è chiaro, soprattutto rispetto ad altre lesioni lichenoidi, sebbene la posizione unilaterale possa aiutare la diagnosi.
- La diagnosi è confermata quando c’è una regressione della lesione dopo l’interruzione o la modifica dell’eventuale farmaco causale e dopo la ricomparsa quando si riprende il trattamento con lo stesso farmaco
- I farmaci devono essere sospesi solo dopo aver consultato il medico del paziente e questa pratica non è sempre fattibile nei pazienti polimedicati.
» View less
Graft-Versus-Host Disease:
- La GVHD è una complicanza che si verifica nei trapiantati di midollo osseo o di cellule staminali ematopoietiche
- Condizione sistemica con una varietà di segni e sintomi e colpisce più sedi e organi, inclusi pelle, cavità orale, occhi, tratto gastrointestinale e fegato, nonché altri sistemi come polmoni, articolazioni e tratto genito-urinario.
- Il coinvolgimento orale della GVHD nella sua forma acuta è estremamente raro; tuttavia, la cavità orale è una delle sedi più comunemente colpite nella GVHD cronica.
- Quando la GVHD cronica colpisce la mucosa orale, è clinicamente caratterizzata da un’infiammazione lichenoide che coinvolge frequentemente la lingua e la mucosa orale ma può interessare qualsiasi sede del cavo orale e può variare da una malattia limitata con solo lievi alterazioni a una più estesa e sintomatica patologia.
- I cambiamenti clinici includono papule, placche bianche e strie ipercheratosiche che ricordano le strie di Wickham che si trovano nell’OLP, così come eritema e ulcere pseudomembranose.
- Le caratteristiche cliniche di per sé sono spesso sufficienti per stabilire la diagnosi, purché siano presenti nel contesto di un paziente che ha subito un trapianto allogenico di cellule staminali ematopoietiche.
Riferimenti e ulteriori letture
Khudhur AS, Di Zenzo G, Carrozzo M. Reazioni del tessuto lichenoide orale: diagnosi e classificazione. Esperto Rev Mol Diagn. 2014;14:169‐184.
Carrozzo M, Porter S, Mercadante V, Fedele S. Oral lichen planus: A disease or a spectrum of tissue reactions? Types, causes, diagnostic algorhythms, prognosis, management strategies. Periodontol 2000. 2019 Jun;80(1):105-125.
Warnakulasuriya S, Kujan O, Aguirre-Urizar JM, Bagan JV, González-Moles MÁ, Kerr AR, et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020 (In press)
McCartan BE, Healy CM. The reported prevalence of oral lichen planus: a review and critique. J Oral Pathol Med 2008;37(8):447–53.
González-Moles MA, Warnakulasuriya S, González-Ruiz I, González-Ruiz L, Ayén Á, Lenouvel D, Ruiz-Ávila I, Ramos-García P. Worldwide prevalence of oral lichen planus: A systematic review and meta-analysis. Oral Dis 2020 (In press)
Warnakulasuriya S. White, red, and mixed lesions of oral mucosa: A clinicopathologic approach to diagnosis. Periodontol 2000 2019;80(1):89-104.
van der Meij EH, Mast H, van der Waal I. The possible premalignant character of oral lichen planus and oral lichenoid lesions: a prospective five-year follow-up study of 192 patients. Oral Oncol. 2007;43(8):742-8
Fitzpatrick SG, Hirsch SA, Gordon SC. The malignant transformation of oral lichen planus and oral lichenoid lesions: a systematic review. J Am Dent Assoc. 2014 Jan;145(1):45-56.
Aghbari SMH, Abushouk AI, Attia A, Elmaraezy A, Menshawy A, Ahmed MS, Elsaadany BA, Ahmed EM. Malignant transformation of oral lichen planus and oral lichenoid lesions: A meta-analysis of 20095 patient data. Oral Oncol. 2017;68:92-102
González-Moles MÁ, Ruiz-Ávila I, González-Ruiz L, Ayén Á, Gil-Montoya JA, Ramos-García P. Malignant transformation risk of oral lichen planus: A systematic review and comprehensive meta-analysis. Oral Oncol. 2019;96:121-130
González-Moles MÁ, Warnakulasuriya S, González-Ruiz I, González-Ruiz L, Ayén Á, Lenouvel D, et al. Clinical interpretation of findings from a systematic review and a comprehensive meta-analysis on clinicopathological and prognostic characteristics of oral squamous cell carcinomas (OSCC) arising in patients with oral lichen planus (OLP): Author’s reply. Oral Oncol. 2020 (In press).
González-Moles MÁ, Ramos-García P, Warnakulasuriya S. An appraisal of highest quality studies reporting malignant transformation of oral lichen planus based on a systematic review. Oral Dis. 2020 (In press).
Idrees M, Kujan O, Shearston K, Farah CS. Oral lichen planus has a very low malignant transformation rate: A systematic review and meta-analysis using strict diagnostic and inclusion criteria. J Oral Pathol Med. 2020 (in Press).
Speight PM, Khurram SA, Kujan O. Oral potentially malignant disorders: risk of progression to malignancy. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125(6):612-627.
Gonzalez-Moles MA, Scully C, Gil-Montoya JA. Oral lichen planus: controversies surrounding malignant transformation. Oral Dis 2008; 14:229–243.
Mignogna MD, Fedele S, Lo Russo L, Mignogna C, de Rosa G, Porter SR. Field cancerization in oral lichen planus. Eur J Surg Oncol. 2007;33(3):383-9
González-Moles MÁ, Warnakulasuriya S, González-Ruiz I, González-Ruiz L, Ayén Á, Lenouvel D, Ruiz-Ávila I, Ramos-García P. Clinicopathological and prognostic characteristics of oral squamous cell carcinomas arising in patients with oral lichen planus: A systematic review and a comprehensive meta-analysis. Oral Oncol. 2020 (In press)
Andreasen JO. Oral lichen planus. 1. A clinical evaluation of 115 cases. Oral Surg Oral Med Oral Pathol 1968;25(1):31–42.
Alrashdan MS, Cirillo N, McCullough M. Oral lichen planus: a literature review and update. Arch Dermatol Res. 2016;308(8):539-51.
Silverman S Jr, Gorsky M, Lozada-Nur F. A prospective follow-up study of 570 patients with oral lichen planus: persistence, remission, and malignant association. Oral Surg Oral Med Oral Pathol. 1985;60(1):30-4
Au J, Patel D, Campbell JH. Oral lichen planus. Oral Maxillofac Surg Clin North Am. 2013 Feb;25(1):93-100, vii.
De Rossi SS, Ciarrocca K. Oral lichen planus and lichenoid mucositis. Dent Clin North Am 2014;58: 299–313.
Leao JC, Ingafou M, Khan A, Scully C, Porter S. Desquamative gingivitis: retrospective analysis of disease associations of a large cohort. Oral Dis. 2008;14(6):556–60.
Müller S. Oral lichenoid lesions: distinguishing the benign from the deadly. Mod Pathol. 2017 Jan;30(s1):S54-S67.
Scully C, Carrozzo M Oral mucosal disease: lichen planus. Br J Oral Maxillofac Surg 2008; 46:15–21.
Robledo-Sierra J, van der Waal I. How general dentists could manage a patient with oral lichen planus. Med Oral Patol Oral Cir Bucal. 2018;23(2):e198-e202
Tziotzios C, Lee JYW, Brier T, Saito R, Hsu CK, Bhargava K, Stefanato CM, Fenton DA, McGrath JA. Lichen planus and lichenoid dermatoses: Clinical overview and molecular basis. J Am Acad Dermatol. 2018;79(5):789-804.
Parashar P. Oral lichen planus. Otolaryngol Clin North Am 2011;44:89–107.
Fox LP, Lightdale CJ, Grossman ME. Lichen planus of the esophagus: what dermatologists need to know. J Am Acad Dermatol. 2011;65(1):175-83
Eisen D. The evaluation of cutaneous, genital, scalp, nail, esophageal,and ocular involvement in patients with oral lichen planus.Oral SurgOral Med Oral Pathol Oral Radiol Endod 1999;88:431–6
Cassol-Spanemberg J, Rodríguez-de Rivera-Campillo ME, Otero-Rey EM, Estrugo-Devesa A, Jané-Salas E, López-López J. Oral lichen planus and its relationship with systemic diseases. A review of evidence. J Clin Exp Dent. 2018;10(9):e938-e944.
Baccaglini L, Thongprasom K, Carrozzo M, Bigby M. Urban legends series: lichen planus. Oral Dis. 2013;19(2):128-43
Bigby M. The relationship between lichen planus and hepatitis C clarified. Arch Dermatol 2009; 145: 1048–1050.
Kuten-Shorrer M, Menon RS, Lerman MA. Mucocutaneous Diseases. Dent Clin North Am. 2020 Jan;64(1):139-162.
Lopes MA, Feio P, Santos-Silva AR, Vargas PA. Proliferative verrucous leukoplakia may initially mimic lichenoid reactions. World J Clin Cases. 2015 Oct 16;3(10):861-3
McParland H, Warnakulasuriya S. Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J Oral Pathol Med. 2020 (In press)
Gilligan G, Garola F, Piemonte E, Leonardi N, Panico R, Warnakulasuriya S. Lichenoid proliferative leukoplakia, lichenoid lesions with evolution to proliferative leukoplakia or a continuum of the same precancerous condition? A revised hypothesis. J Oral Pathol Med. 2020 (In press)
Van der Meij EH, Van der Waal I. Lack of clinicopathologic correlation in the diagnosis of oral lichen planus based on the presently available diagnostic criteria and suggestions for modifications. J Oral Pathol Med. 2003;32:507‐512.
Eisenberg E. Clinical controversies in oral and maxillofacial surgery: part one. Oral lichen planus: a benign lesion. J Oral Maxillofac Surg 2000;58:1278-85.
Al-Hashimi I, Schifter M, Lockhart PB, Wray D, Brennan M, Migliorati CA, et al. Oral lichen planus and oral lichenoid lesions: diagnostic and therapeutic considerations. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103 (suppl):1-12.
Yamanaka Y, Yamashita M, Innocentini LMA, Macedo LD, Chahud F, Ribeiro-Silva A, Roselino AM, Rocha MJA, Motta AC. Direct Immunofluorescence as a Helpful Tool for the Differential Diagnosis of Oral Lichen Planus and Oral Lichenoid Lesions. Am J Dermatopathol. 2018;40(7):491-497.
Salgado DS, Jeremias F, Capela MV, et al. Plaque control improves the painful symptoms of oral lichen planus gingival lesions. A short-term study. J Oral Pathol Med. 2013;42: 728-732.
Holmstrup P, Schiøtz AW, Westergaard J. Effect of dental plaque control on gingival lichen planus. Oral Surg Oral Med Oral Pathol.1990;69:585‐590.
Adamo D, Calabria E, Coppola N, Lo Muzio L, Giuliani M, Bizzoca ME, et al. Psychological profile and unexpected pain in oral lichen planus: a case-control multicenter SIPMO study. Oral Dis. 2021 (In press)
González-García A, Diniz-Freitas M, Gándara-Vila P, Blanco-Carrión A, García-García A, Gándara-Rey J. Triamcinolone acetonide mouth rinses for treatment of erosive oral lichen planus: efficacy and risk of fungal over-infection. Oral Dis. 2006;12(6):559-65.
Lodi G, Pellicano R, Carrozzo M. Hepatitis C virus infection and lichen planus: a systematic review with meta-analysis. Oral Diseases. 2010;16:601–12
Gonzalez-Moles MA, Ruiz-Avila I, Rodriguez-Archilla A, Morales-Garcia P, Mesa-Aguado F, Bascones-Martinez A, Bravo M. Treatment of severe erosive gingival lesions by topical application of clobetasol propionate in custom trays. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003;95(6):688-92.
Gonçalves S., Dionne R.A., Moses G., Carrozzo M. Pharmacotherapeutic Approaches in Oral Medicine. In: Farah C., Balasubramaniam R., McCullough M, (eds). Contemporary Oral Medicine. A comprehensive approach to clinical practice. Springer, Switezerland, 2019.
Carbone M, Goss E, Carrozzo M, et al. Systemic and topical corticosteroid treatment of oral lichen planus: a comparative study with long-term follow-up. J Oral Pathol Med. 2003;32:323‐329.
Eisen D. Hydroxychloroquine sulfate (Plaquenil) improves oral lichen planus: An open trial. J Am Acad Dermatol 1993;28:609–12.
Ho JK, Hantash BM. Systematic review of current systemic treatment options for erosive lichen planus. Expert Rev Dermatol 2012;7:269–82.
Wee JS, Shirlaw PJ, Challacombe SJ, Setterfield JF. Efficacy of mycophenolate mofetil in severe mucocutaneous lichen planus: a retrospective review of 10 patients. Br J Dermatol 2012;167:36–43.
Torti DC, Jorizzo JL, McCarty MA. Oral lichen planus: a case series with emphasis on therapy. Arch Dermatol 2007;143:511–5.
Bruch JM, Treister NS. Immune-Mediated and Allergic Conditions. In: Bruch JM, Treister NS, (eds). Clinical Oral Medicine and Pathology. Humana Press, 2009.
Mignogna MD, Fedele S, Lo Russo L. Dysplasia/neoplasia sur-veillance in oral lichen planus patients: a description of clinical criteria adopted at a single centre and their impact on prognosis. Oral Oncol. 2006;42:819-24.
Ismail SB, Kumar SK, Zain RB. Oral lichen planus and lichenoid reactions: etiopathogenesis, diagnosis, management and malignant transformation. J Oral Sci 2007;49:89–106
Epstein JB, Wan LS, Gorsky M, Zhang L. Oral lichen planus: progress in understanding its malignant potential and the implications for clinical management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003;96 (1):32–7.
Elhadad MA, Gaweesh Y. Hawley retainer and lichenoid reaction: a rare case report. BMC Oral Health. 2019 ;19(1):250.
Larsson A, Warfvinge G. Oral lichenoid contact reactions may occasionally transform into malignancy. Eur J Cancer Prevention 2005;14:525-9.
McCartan BE, McCreary CE. Oral lichenoid drug eruptions. Oral Dis 1997;3:58-63.
Den Haute VV, Antoine JL, Lachapelle JM. Histopathological discriminant criteria between lichenoid drug eruption and idiopathic lichen planus: retrospective study on selected samples. Dermatology. 1989;179:10‐13.
Schmidt-Westhausen AM. Oral lichen planus and lichenoid lesions: what’s new? Quintessence Int. 2020;51(2):156-161
Fortuna G, Aria M, Schiavo JH. Drug-induced oral lichenoid reactions: a real clinical entity? A systematic review. Eur J Clin Pharmacol. 2017;73(12):1523-1537.
Warnakulasuriya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018 ;125(6):582-590.
Kuten-Shorrer M, Woo SB, Treister NS. Oral graft-versus-host disease. Dent Clin North Am. 2014;58(2):351-68.