Il lupus eritematoso discoide (DLE) è una condizione infiammatoria cronica che colpisce la pelle e la mucosa orale. Il DLE è la variante più comune del lupus cutaneo cronico e comprende l’80% dei casi. La fisiopatologia della malattia è complessa e coinvolge molteplici fattori tra cui la genetica, i fattori ambientali e il sistema immunitario innato e adattativo. I fattori scatenanti ambientali più comuni per il DLE includono l’irradiazione UV, i farmaci, la radioterapia e il fumo.
Epidemiologia
- La prevalenza di DLE varia da 9 a 70 casi per 100.000 abitanti.
- L’incidenza del DLE è 3-5 volte maggiore nei gruppi etnici asiatici e neri rispetto ai gruppi etnici bianchi
- Prevalentemente colpisce le donne con un rapporto femmine-maschio di 3:1.
- Molti sviluppano il quadro patologico tra i 20 e i 40 anni di età.
- Le lesioni orale sono presenti in circa il 20% dei pazienti affetti da DLE.
- La presenza di lesioni orali in pazienti con DLE in assenza di interessamento cutaneo è molto raro, rappresentato solo dal 10% di casi.
Presentazione clinica
- La presentazione più comune del lupus cutaneo cronico è il DLE, che può presentarsi come tipo localizzato (80%) con lesioni che si presentano sul viso, sulle orecchie e sul cuoio capelluto.
- Il DLE disseminato (20% dei casi) si presenta con lesioni sopra e sotto il collo ed è associato ad un aumentato rischio di progressione al lupus eritematoso sistemico.
Lesioni cutanee:
- Nel DLE le lesioni cutanee sulle aree esposte al sole del viso e del collo si presenta con eritema anulare e ipercheratosi follicolare. È stata descritta una caratteristica placca con motivo a farfalla sopra l’area malare del viso e il ponte del naso.
- Le lesioni cutanee possono essere accompagnate da prurito o sensazione di bruciore.
- Con il progredire delle lesioni cutanee, si verificano atrofia centrale, cicatrici, teleangectasie e ipopigmentazione. Si verifica anche alopecia cicatriziale irreversibile sul cuoio capelluto
Lesioni orali:
- Le lesioni orali si verificano in circa il 20% dei casi e colpiscono tipicamente le labbra, il palato duro e la mucosa buccale
- Le lesioni del DLE orali sono caratterizzate dalla presenza di eritema centrale o ulcerazione circondata da papule ipercheratosiche o strie radianti e teleangectasie periferiche (Figure 1 e 2). L’aspetto “a nido d’ape” si verifica nelle lesioni di lunga data.
- Lesioni mucose possono verificarsi senza coinvolgimento della pelle o prima dello sviluppo di lesioni cutanee. Le lesioni delle labbra possono diffondersi fino a coinvolgere la pelle adiacente, oscurando il bordo vermiglio.
- Può essere presente anche gengivite desquamativa che interessa la gengiva inferiore e/o superiore.
- Con la guarigione, le lesioni erosive possono lasciare la pigmentazione post-infiammatoria.
- I sintomi più comuni di DLE includono una sensazione di bruciore, fotosensibilità, secchezza, sensibilità e dolore, ma le lesioni possono essere asintomatiche.
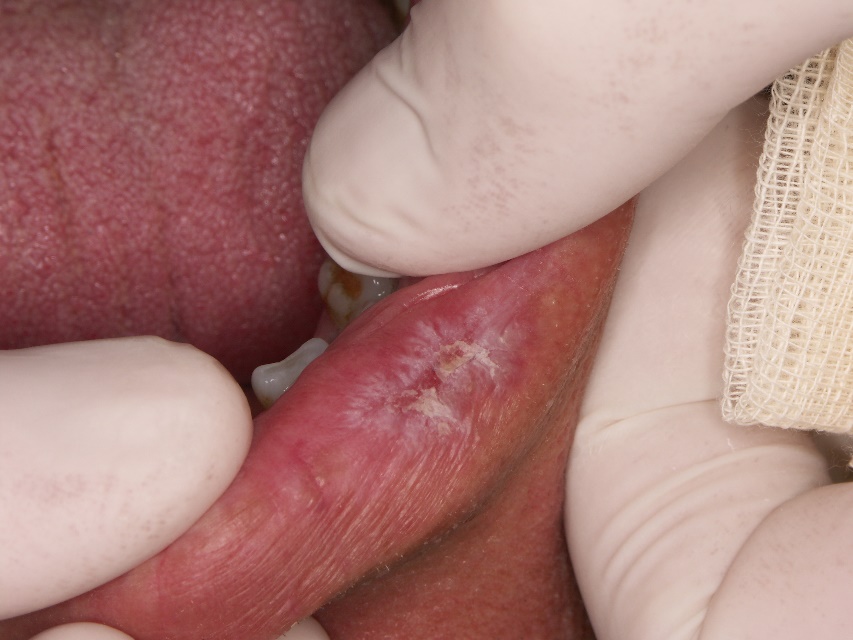
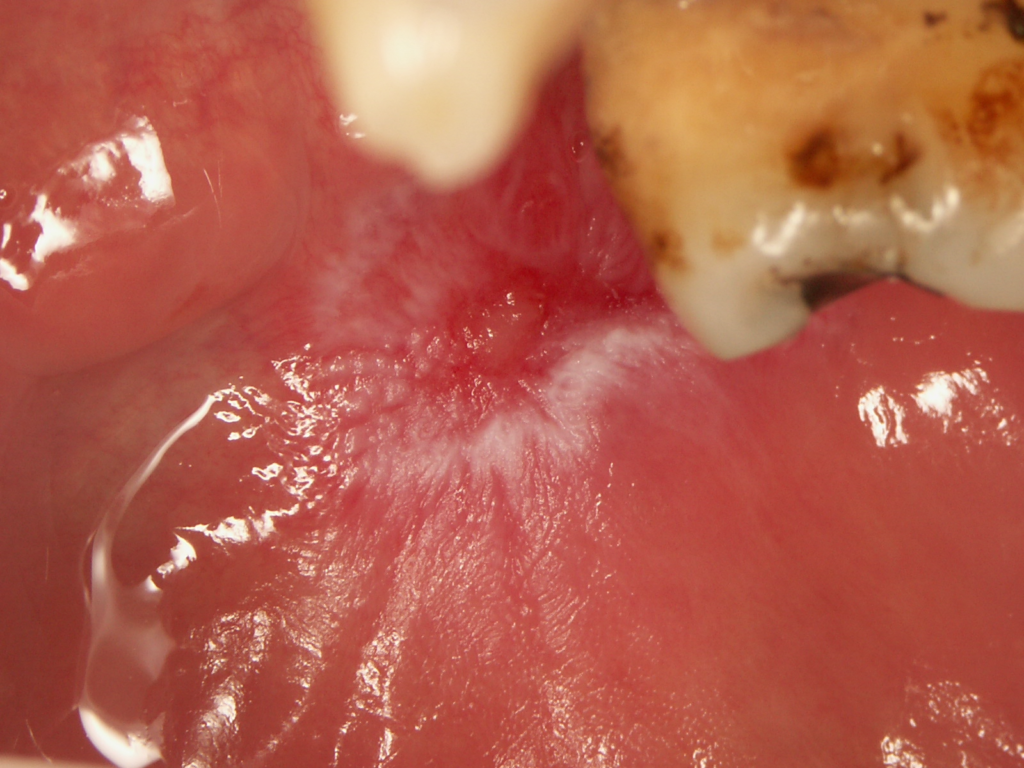
- I pazienti con DLE hanno un rischio maggiore di cancro, compreso il cancro della pelle non melanoma e il cancro orale, rispetto alla popolazione generale
- L’Organizzazione Mondiale della Sanità ha classificato il DLE come un disturbo orale potenzialmente maligno sebbene la trasformazione maligna sia rara.
- Più comunemente, la trasformazione maligna si verifica nelle lesioni del DLE localizzate al bordo vermiglio del labbro, con il labbro inferiore più spesso colpito.
- L’esposizione a lungo termine alla luce ultravioletta, le cicatrici croniche, l’infezione da HPV e la terapia immunosoppressiva a lungo termine possono essere fattori predisponenti per lo sviluppo di SCC. La durata media dall’inizio del DLE allo sviluppo del cancro del labbro è più breve rispetto ai tumori originati da lesioni DLE in altri siti (10-13 anni vs. 19-26 anni).
- I tumori correlati al DLE sono più aggressivi e hanno un potenziale metastatico più elevato (10-25%), tassi di recidiva (27-29%) e mortalità (19,4%) rispetto ai tumori non correlati al DLE (20%, 0,5-6% e 1 %, rispettivamente)
Diagnosi differenziali
La diagnosi differenziale delle lesioni orali di DLE comprendeno il lichen planus orale (OLP), le lesioni lichenoidi, la leucoplachia orale e la cheilite attinica (quando è colpito il labbro inferiore).
Nel caso del Lichen Planes Orale, le lesioni sono più diffuse e distribuite in modo più simmetrico e il pattern reticolare è più pronunciato a differenza delle lesioni orali da DLE.
Le lesioni lichenoidi si presentano come strie bianche nei siti direttamente a contatto con il restauro dell’amalgama. Dopo la rimozione del restauro, la lesione migliora o si risolve.
La leucoplachia orale non mostra un pattern radiale di strie ipercheratosiche e non si presenta con atrofia centrale.
La cheilite attinica di solito coinvolge il labbro inferiore e si presenta con croste e senza formazione di strie.
Diagnosi
- La diagnosi di DLE può essere difficile alla luce delle somiglianze con il lichen planus orale in istopatologia.
- I reperti istologici del DLE orale includono ipercheratosi con spine cheratosiche, atrofia delle creste della rete, degenerazione idropica dello strato di cellule basali, mucosite dell’interfaccia con infiltrato linfocitario perivascolare superficiale o profondo, edema nella lamina propria e ispessimento PAS positivo delle pareti dei vasi sanguigni (Figura 3).
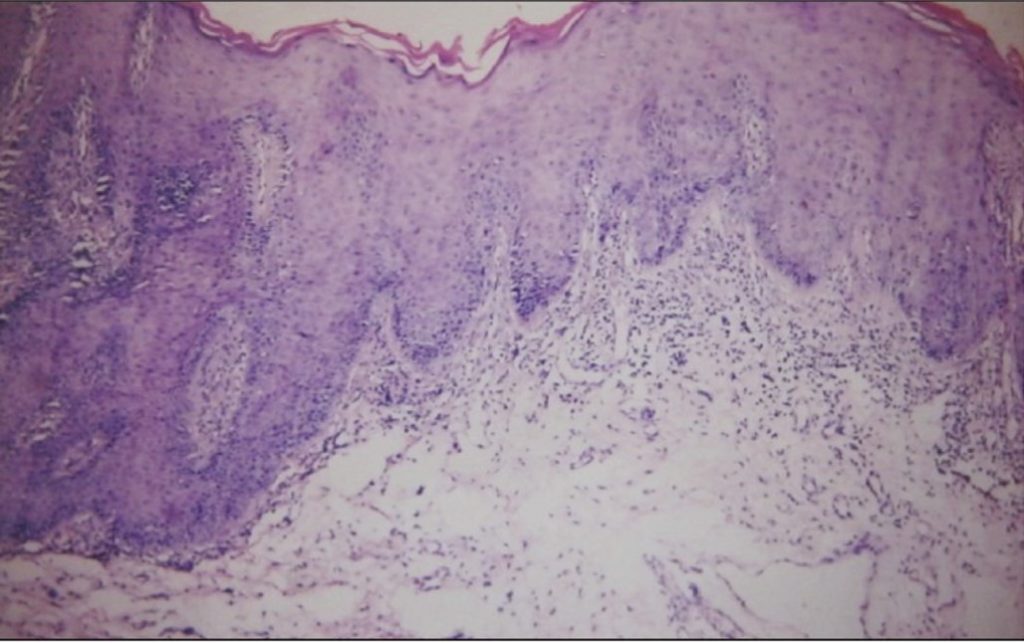
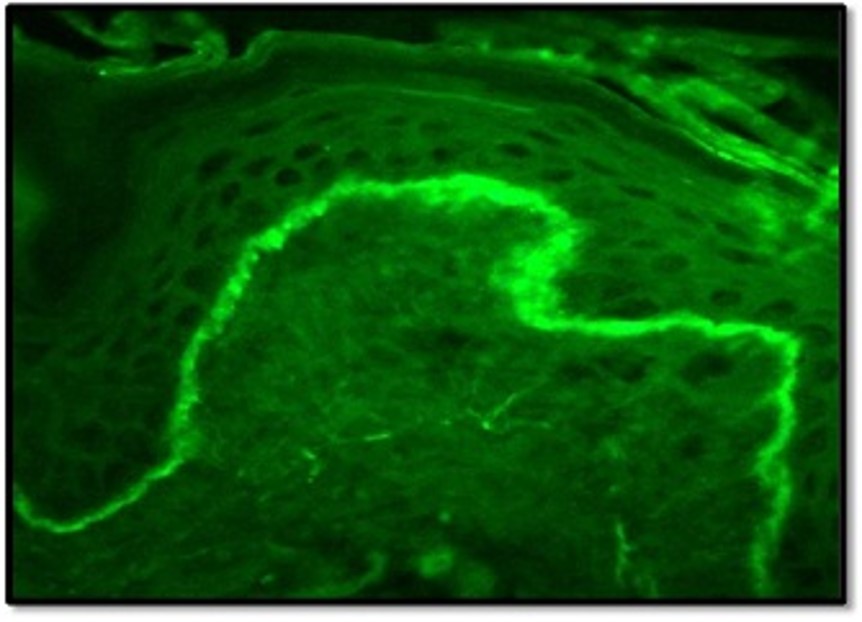
- L’immunofluorescenza diretta (DIF) può essere utile per ulteriori analisi. Le lesioni da DLE dimostrano una deposizione lineare o granulare di IgM, IgG e complemento 3 (C3) nella zona della membrana basale, la “banda del lupus” (Figura 4).
- Contrariamente al DLE, i depositi di fibrinogeno possono essere trovati nel 90-100% dei pazienti con il quadro di Lichen planus Orale lungo la membrana basale. A causa della marcata differenza nei risultati del DIF tra DLE e il lichen planus orale, molti autori ritengono che il DIF dovrebbe far parte dello standard diagnostico quando è sospetto un quadro di Lupus Eritematoso Discoidi.
- Anomalie sierologiche ed ematologiche possono essere rilevate nei pazienti con DLE. In alcuni casi, la velocità di eritrosedimentazione può essere elevata. Circa il 20% dei pazienti ha anticorpi antinucleari (ANA) positivi e fino al 20% ha autoanticorpi SS-A. Gli autoanticorpi anti-Sm, solitamente osservati nel lupus eritematoso sistemico, possono verificarsi nel 5-20% dei pazienti con DLE.
Gestione
- I pazienti devono essere informati della possibilità di progressione verso una malattia sistemica. Il rischio di progressione da DLE a SLE è del 16,7% entro 3 anni dalla diagnosi e del 17% entro 8 anni dalla diagnosi. Le misure preventive includono evitare l’esposizione ai raggi UV e smettere di fumare.
- Esistono alcune evidenze circa l’utilizzo della crema topica di fluocinonide, idrossiclorochina sistemica e acitretina in pazienti con DLE che colpisce la pelle, mentre le prove per la gestione del DLE orale sono scarse.
Lesioni orali localizzate:
- Il trattamento topico è di prima linea. I corticosteroidi topici (triamcinolone acetonide, betametasone valerato, clobetasolo diproprionato, idrocortisone, fluocinolone acetonide) sono il cardine della terapia.
- Possono essere utilizzati anche inibitori della calcineurina (tacrolimus, pimecrolimus).
- L’iniezione intralesionale di corticosteroidi (triamcinolone acetonide) è utile per le lesioni individuali.
Lesioni recalcitranti o malattia diffusa
- Spesso è necessaria una terapia sistemica, ad esempio gli antimalarici (idrossiclorochina, clorochina e chinacrina) da soli o in combinazione con corticosteroidi sistemici sono usati come farmaci sistemici di prima linea.
- Nei casi più gravi, immunomodulatori (dapsone, talidomide, lenalidomide) e/o retinoidi orali (acitretina, isotretinoina, alitretinoina) e/o immunosoppressori (metotrexato, azatioprina, ciclofosfamide, micofenolato mofetile, micofenolato sodico, ciclosporina).
- Gli agenti biologici (rituximab, belimumab) sono usati nei casi più gravi.
I pazienti con DLE devono essere monitorati a intervalli regolari. La risposta alla terapia varia da paziente a paziente, variando da poche settimane a mesi. Ciascun paziente deve essere gestito caso per caso ai fini del controllo dei sintomi e della sorveglianza di potenziali trasformazioni maligne.
Riferimenti e ulteriori letture
Warnakulasurya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:582–90.
Stannard JN, Kahlenberg JN. Cutaneous lupus erythematosus: updates on pathogenesis and associations with systemic lupus. Curr Opin Rheumatol. 2016;28(5): 453–9.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Cutaneous lupus erythematosus and the association with systemic lupus erythematosus: a population-based cohort of 1088 patients in Sweden. Br J Dermatol. 2011;164(6):1335-41.
Blake SC, Daniel BS. Cutaneous lupus erythematosus: A review of the literature. Int J Womens Dermatol. 2019;5(5):320-9.
Szczęch J, Samotij D, Werth DP, Reich A. Trigger factors of cutaneous lupus erythematosus: a review of current literature. Lupus. 2017;26(8):791-807.
Izmirly PM, Buyon JP, Belmont HM, Sahl S, Wan I, Salmon JE et al. Prevalenza basata sulla popolazione e stime di incidenza del lupus eritematoso discoide primario dal Manhattan Lupus Surveillance Program. Lupus Sci Med. 2019;6(1):e000344.
Jarukitsopa S, Hoganson DDD, Crowson CS, Sokumbi O, Davis MD, Michet CJ et al. Epidemiology of Systemic Lupus Erythematosus and Cutaneous Lupus in a Predominantly White Population in the United States. Arthritis Care Res. 2015; 67(6): 817–28.
Drenkard C, Parker S, Aspey LD, Gordon C, Helmick CG, Bao G, Sam Lim S. Racial disparities in the incidence of primary chronic cutaneous lupus erythematosus in the southeastern US: the Georgia lupus registry. Arthritis Care Res. 2019; 71:95–103.
Nico MMS, Apparecida M, Vileila C, Rivitti EA, Lourenco SV. Oral lesions in lupus erythematosus: correlation with cutaneous lesions. Eur J Dermatol 2008;18(4):376-81.
Menzies S, O’Shea F, Galvin S, Wynne B. Oral manifestations of lupus. Ir J Med Sci. 2018; 187:91–3.
Ranginwala AM, Chalishazar MM, Panja P, Buddhdev KP, Kale HM. Oral discoid lupus erythematosus: A study of twenty-one cases. J Oral Maxillofac Pathol. 2012;16(3): 368–73.
Lallas A, Apalla Z, Lefaki I, et al. Dermoscopy of discoid lupus erythematosus. Br J Dermatol 2013;168: 284–8.
McDaniel B, Sukumaran S,Tanner LS. Discoid Lupus Erythematosus. NCBI Bookshelf. A service of the National Library of Medicine, National Institutes of Health. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-.
Shafer WG, Hine MK, Levy BM. A textbook of oral pathology. 7th ed. Philadelphia: W B Saunders;1999. p. 8992.
Kranti K, Seshan H, Juliet J. Discoid lupus erythematosus involving gingiva. J Indian Soc Periodontol. 2012;16(1): 126–8.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Increased risk of cancer among 3663 patients with cutaneous lupus erythematosus: A Swedish nationwide cohort study. Br J Dermatol 2012; 166: 1053–1059.
de Berker D, Dissaneyeka M, Burge S. The sequelae of chronic cutaneous lupus erythematosus. Lupus 1992;1:181-6.
Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-580.
Arvanitidou IE, Nikitakis NG, Georgaki M, Papadogeorgakis N, Tzioufas A, Sklavounou A. Multiple primary squamous cell carcinomas of the lower lip and tongue arising in discoid lupus erythematosus: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:e22-e30.
Fernandes MS, Girisha BS, Viswanathan N, Sripathi H and Noronha TM. Discoid lupus erythematosus with squamous cell carcinoma: a case report and review of the literature in Indian patients. Lupus. 2015; 24: 1562–6.
Sherman RN, Lee CW, Flynn KJ. Cutaneous squamous cell carcinoma in black patients with chronic discoid lupus erythematosus. Int J Dermatol 1993; 32: 677–679.
Liu W, Shen ZY, Wang LJ, et al. Malignant potential of oral and labial chronic discoid lupus erythematosus: A clinicopathological study of 87 cases. Histopathology 2011; 59: 292–298.
Makita E, Akasaka E, Sakuraba Y, Korekawa A, Aizu T, Kaneko T et al. Squamous cell carcinoma on the lip arising from discoid lupus erythematosus: a case report and review of Japanese patients. Eur J Dermatol. 2016;26(4):395-6.
Makita E, Akasaka E, Sakuraba Y, Korekawa A, Aizu T, Kaneko T et al. Squamous cell carcinoma on the lip arising from discoid lupus erythematosus: a case report and review of Japanese patients. Eur J Dermatol. 2016;26(4):395-6.
Naik V, Prakash S. Oral Discoid Lupus Erythematosus: A Case Effectively Managed and Differentiated with other Overlapping Diseases. Indian J Dent Adv 2018;9(4): 221-5.
Del Barrio‐Díaz P, Reyes‐Vivanco C, Cifuentes‐Mutinelli M, Manríquez J, Vera‐Kellet C. Association between oral lesions and disease activity in lupus erythematosus. J Eur Acad Dermatol Venereol. 2020;34(2):349-356.
Martins da Costa Marques ER, Silva R, Hsieh R. Oral Mucosal Manifestation of Lupus Erythematosus: A Short Review. DOBCR. doi: 10.31487/j.DOBCR.2020.02.09
Bhushan R, Agarwal S, Chander R, Agarwal K. Direct Immunofluorescence Study in Discoid Lupus Erythematosus. World Journal of Pathology 2017; 9:56-60.
Biazar C. Sigges J. Patsinakidis N. Ruland V. Amler S. Bonsmann G. Kuhn A. Cutaneous lupus erythematosus: first multicenter database analysis of 1002 patients from the European Society of Cutaneous Lupus Erythematosus (EUSCLE).Autoimmun Rev. 2013; 12(3):444-454.
Wieczorek I.T., Propert K.J., Okawa J, Werth V.P. Systemic symptoms in the progression of cutaneous to systemic lupus erythematosus. JAMA Dermatol. 2014; 150(3):291-6.
Jessop S, Whitelaw DA, Grainge MJ, Jayasekera P. Drugs for discoid lupus erythematosus. Cochrane Database Syst Rev. 2017;5(5):CD002954.
Okon LG, Werth VP. Cutaneous lupus erythematosus: diagnosis and treatment. Best Pract Res Clin Rheumatol. 2013;27: 391-404.







