DEFINIÇÃO
A LVP pode ser considerada uma forma distinta de leucoplasia oral (LO) caracterizada por lesões multifocais, evolução clínica progressiva e alterações na aparência clínica e nas características histopatológicas. No entanto, a posição de classificar a LVP como uma entidade separada não é universalmente aceite, uma vez que leucoplasias grandes e generalizadas, e não apenas LVPs, apresentam um risco distinto de transformação maligna.
Em 2020, o Grupo de Trabalho do Collaborating Centre for Oral Cancer da OMS reconheceu que “apesar de o termo LVP não ser perfeito para definir um grupo generalizado de pacientes com lesões multifocais é o termo que mais se utiliza e, portanto, o Work Group recomendou que assim continuasse”. O mesmo grupo propôs a seguinte definição: “uma alteração progressiva, persistente e irreversível, caracterizada pela presença de múltiplas leucoplasias que frequentemente se tornam verrucosas”.
Epidemiologia e Risco de Evolução para Cancro
- Estima-se que a prevalência geral de LO varie entre 1,5% e 2,6%. A LVP é menos comum que a leucoplasia padrão e os dados sobre a sua prevalência não estão disponíveis.
- A etiologia da LVP permanece desconhecida.
- A LVP é mais comum em mulheres idosas, independentemente da raça, e não está associada aos fatores de risco tradicionais da LO nem do Carcinoma de Células Escamosas Oral (CCEO), ou seja, o consumo de tabaco e álcool.
- Aproximadamente dois terços dos casos de LVP ocorrem em pacientes que nunca fumaram e que não relataram consumo excessivo de álcool.
- A prevalência de HPV relatada na LVP varia entre 0 a 88% com base nos resultados de estudos com pequenos números de pacientes.
- Um estudo que investigou a prevalência de HPV em 58 pacientes não mostrou diferenças significativas entre pacientes com patologia de LVP e aqueles com LO convencional (24% contra 25%)
- No primeiro exame histopatológico, a maioria das lesões de LVP (52,5%) mostra hiperqueratose sem displasia ou hiperplasia verrucosa.
- Não obstante, a LVP está associada a uma maior incidência de cancro oral entre as OPMDs, seja carcinoma verrucoso ou carcinoma de células escamosas.
- Aproximadamente 61% dos pacientes com LVP desenvolvem cancro oral num período médio de 7,4 anos, embora tenha sido estimado através de uma revisão sistemática que a transformação maligna ocorre em 49,5% (IC 26,7%-72,4%) dos casos de LVP (Spriano et al., 2020) .
- A taxa anual de transformação maligna é estimada em 10%.
- Como evidenciado por séries de casos recentes, múltiplos carcinomas primários de locais gengivais têm sido relatados na literatura sobre pacientes com LVP.
- A taxa de mortalidade associada à LVP é de cerca de 40%.
Manifestações Clínicas
Clinicamente, a LVP pode envolver uma única grande área da mucosa oral, embora seja frequentemente multifocal, afetando a gengiva, a mucosa oral e a língua em locais contíguos e não contíguos da cavidade oral. Os locais mais afetados pela LVP são a gengiva (62,7%), a mucosa oral (59,8%) e a língua (49,1%). As Figuras 1-4 ilustram vários locais da cavidade oral com LVP.
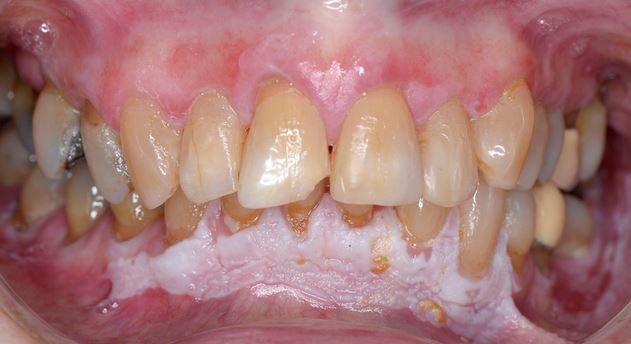
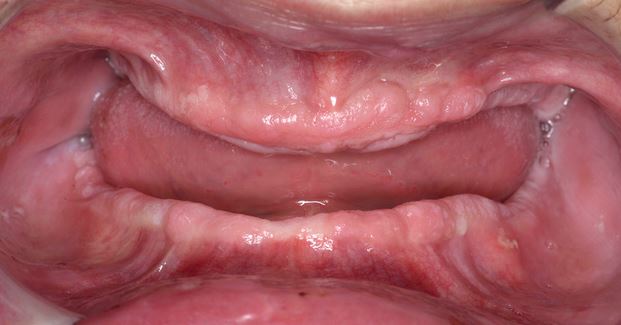
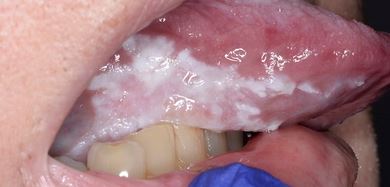
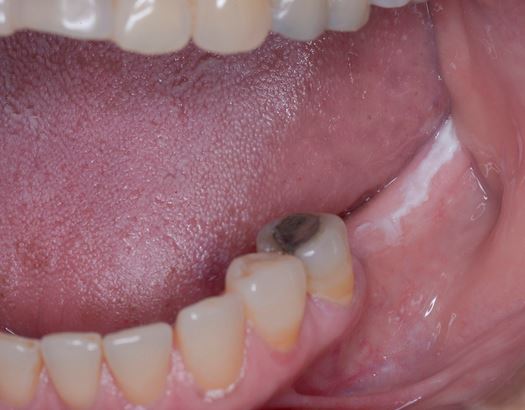
As principais características da LVP são a multifocalidade e a evolução clínica progressiva. As lesões orais na LVP estão frequentemente associadas a alterações contínuas no quadro clínico e histopatológico. A Tabela 1 identifica as características clínicas da LVP, conforme descrito no mais recente relatório sobre OPMDs preparado pelo Collaborating Centre for Oral Cancer da OMS.
| Manifestações Clínicas da LVP |
| Múltiplas manchas brancas espessas em mais de dois locais distintos, frequentemente encontradas na gengiva, rebordos alveolares e palato. |
| A maioria das lesões apresenta um padrão verrucoso. |
| As lesões espalham-se e coalescem durante o desenvolvimento. |
| Recorrência numa área previamente tratada |
Tabela 1: Manifestação clínica da LVP, de acordo com o Collaborating Centre for Oral Cancer (2020) da OMS [4].
Geralmente, a LVP tem início como leucoplasia homogénea sem presença de displasia no exame histológico e evolui progressivamente para lesões verrucosas numa área única ou múltipla da mucosa oral. Na sua fase inicial, a LVP manifesta-se como uma ou mais leucoplasias que progressivamente afetam vários locais com disseminação gradual de uma única lesão ou coalescência de múltiplas lesões [3,4], podendo apresentar-se como uma lesão multifocal sem a aparência verrucosa típica. Além disso, a lesão inicial pode ser branca e plana, por vezes apresentando aspeto liquenoide, dificultando a distinção entre a LVP e o líquen plano oral (LPO) [3,4,28,29]. Nesses casos, a LVP pode ser erroneamente tratada como LPO por longos períodos com o risco subsequente de não confirmar ou atrasar o diagnóstico de um possível carcinoma de células escamosas oral.
A LVP também foi caracterizada por eritema proeminente (19% na série de Villa et al) com uma taxa de transformação maligna (MTR) de 100% quando comparada com as lesões sem componente eritematoso (MTR 62,5%).
Diagnóstico
- As características histopatológicas da LVP não são patognomónicas e são inespecíficas, podendo adquirir o aspeto de hiperqueratose nos estágios iniciais, hiperplasia verrucosa e diferentes graus de displasia.
- Além disso, os casos clinicamente caracterizados por um componente inflamatório ou aparência liquenoide podem apresentar uma banda linfocítica “liquenoide” e ser erradamente diagnosticados como LPO.
- Assim, o diagnóstico definitivo da LVP é feito com base nos resultados clínicos e na caracterização histopatológica.
- Toda a lesão branca que se torne verrucosa e exofítica, com disseminação ao longo do tempo e recorrência após o tratamento, deve ser considerada LVP.
Desde a primeira definição em 1985, outros autores propuseram critérios diagnósticos alternativos. Em 2010, Cerero-Lapiedra et al propuseram cinco critérios major e quatro minor, com as suas combinações específicas, para estabelecer um diagnóstico precoce de LVP (Tabela 2).
| Critérios Major | Critérios Minor |
| Leucoplasia oral afetando mais de dois locais distintos (frequentemente gengiva, palato e rebordo alveolar) | As lesões cobrem uma extensão de mucosa que excede 3 cm (na soma de todas as áreas afetadas) |
| Aparência clínica verrucosa | Género feminino |
| As lesões mostram progressão clínica e metastização | Não-fumador (independentemente do género) |
| Recorrência numa área previamente tratada | Evolução da doença superior a 5 anos |
| Quadro histopatológico de hiperqueratose epitelial oral ou hiperplasia verrucosa, carcinoma verrucoso ou carcinoma de células escamosas. |
O diagnóstico de LVP pode ser estabelecido quando:
três dos critérios major (incluindo o critério histopatológico)
ou dois critérios major (incluindo o critério histopatológico) e dois minor
Tabela 2: Critérios de diagnóstico de LVP de acordo com Cicero-Lapiedra et al. (Modificado por [3,20]).
Carrard et al propuseram simplificar os critérios de diagnóstico da LVP, omitindo a distinção entre critérios major e minor, sugerindo quatro critérios que devem ser observados (Tabela 3).
| Critérios de diagnóstico modificados: todos os quatro devem ser confirmados. |
| Leucoplasia apresentado áreas verrucosas, envolvendo mais de duas sub-regiões orais. São reconhecidas as seguintes sub-regiões: dorso da língua (unilateral ou bilateral), bordo da língua, mucosa jugal, mucosa alveolar ou gengiva superior, mucosa alveolar ou gengiva inferior, palatos duro e mole, pavimento da boca (mucosa por baixo da língua), lábio superior e lábio inferior. |
| Somando todos os locais envolvidos, o tamanho mínimo da amostra deve ser de, pelo menos, três centímetros. |
| Um período de evolução de doença bem documentado de pelo menos cinco anos, sendo caracterizado por disseminação e aumento e ocorrência de uma ou mais reincidências numa área previamente tratada. |
| Deve ser realizada pelo menos uma biópsia para descartar a presença de carcinoma verrucoso ou carcinoma de células escamosas. |
Tabela 3: Critérios de diagnóstico de LVP simplificados.
- Ao obter uma biópsia de uma lesão suspeita de LVP, bem como de LO não-homogénea, é importante escolher as partes mais representativas para evitar o subdiagnóstico.
- O exame histopatológico pode levar a um diagnóstico variável dentro de uma mesma lesão. Por esse motivo, várias biópsias de mapeamento são frequentemente recomendadas. Biópsias de mapeamento múltiplas e periódicas são recomendadas em casos de LVP para detetar diferentes graus de displasia ou para excluir CCEO.
- Foi relatado em casos de LVP e LO não-homogénea que podem não ser diagnosticados aproximadamente 10% a 17% dos casos de CCEO com a realização de apenas uma única biópsia.
Tratamento e Prevenção
- O tratamento e a prevenção da LVP são particularmente desafiantes. Na última década, foram propostas diferentes abordagens para reduzir a alta incidência de cancro oral em pacientes com LVP.
- Até ao momento, nenhum dos tratamentos (cirurgia, exérese com laser, retinoides, terapia fotodinâmica e quimioterapia) se mostrou eficaz na redução do risco de desenvolvimento do cancro oral nesses pacientes.
- Apesar da falta de evidências sobre a eficácia, o tratamento cirúrgico é a intervenção mais frequente no tratamento da LVP.
- Quando a LVP é caracterizada por pequenas lesões, e se a área for discreta, pode ser tentada a exérese. Contudo, o paciente deve estar ciente de que será necessário acompanhamento contínuo devido ao alto risco de cancro oral e de recidiva da lesão (71%).
- A maioria dos casos de LVP demonstra grandes lesões e envolve áreas multifocais não contíguas.
- Uma revisão sistemática recente evidencia que a taxa geral de recidiva de LVP em todas as modalidades de tratamento é de aproximadamente 85%, sem qualquer redução na incidência de cancro.
- Por todas essas razões, a excisão cirúrgica de LVP extensa pode ser considerada uma opção de tratamento agressivo, impraticável e desnecessário.
- Muitos médicos escolhem uma abordagem de “esperar e ver”, sempre acompanhadas de múltiplas biópsias periódicas e examinação clínica regular.
- O objetivo desta abordagem é identificar o início muito precoce do cancro oral, proporcionando o melhor resultado e prognóstico do tratamento.
Em conclusão, e considerando a alta incidência de cancro em pacientes com LVP, múltiplas biópsias e o acompanhamento clínico rigoroso são obrigatórios (a cada 3-6 meses, dependendo das características clínicas). O momento da transformação maligna é imprevisível, portanto, o acompanhamento contínuo é imprescindível.
Read more
1. Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, 60, 285–298, doi:10.1016/0030-4220(85)90313-5.
2. Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9, 122, doi:10.1186/1477-7819-9-122.
3. Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760, doi:10.1111/odi.12830.
4. Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
5. Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
6. van der Waal, I. Oral leukoplakia; a proposal for simplification and consistency of the clinical classification and terminology. Med. Oral Patol. Oral y Cir. Bucal 2019, 24, e799–e803, doi:10.4317/medoral.23372.
7. Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003, 39, 770–780, doi:10.1016/S1368-8375(03)00102-7.
8. Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
9. Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental practitioners. Br. Dent. J. 2017, 223, 655–661, doi:10.1038/sj.bdj.2017.881.
10. Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2021, 27, 919–923, doi:10.1111/odi.13622.
11. Bagan, J. V.; Jimenez, Y.; Murillo, J.; Gavaldá, C.; Poveda, R.; Scully, C.; Alberola, T.M.; Torres-Puente, M.; Pérez-Alonso, M. Lack of Association Between Proliferative Verrucous Leukoplakia and Human Papillomavirus Infection. J. Oral Maxillofac. Surg. 2007, 65, 46–49, doi:10.1016/j.joms.2005.12.066.
12. Palefsky, J.M.; Silverman, S.; Abdel‐Salaam, M.; Daniels, T.E.; Greenspan, J.S. Association between proliferative verrucous leukoplakia and infection with human papillomavirus type 16. J. Oral Pathol. Med. 1995, 24, 193–197, doi:10.1111/j.1600-0714.1995.tb01165.x.
13. Campisi, G.; Giovannelli, L.; Ammatuna, P.; Capra, G.; Colella, G.; Di Liberto, C.; Gandolfo, S.; Pentenero, M.; Carrozzo, M.; Serpico, R.; et al. Proliferative verrucous vs conventional leukoplakia: No significantly increased risk of HPV infection. Oral Oncol. 2004, 40, 835–840, doi:10.1016/j.oraloncology.2004.02.007.
14. Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
15. Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
16. Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
17. Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
18. Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2021, 115, 105121, doi:10.1016/j.oraloncology.2020.105121.
19. Capella, D.L.; Gonçalves, J.M.; Abrantes, A.A.A.; Grando, L.J.; Daniel, F.I. Proliferative verrucous leukoplakia: diagnosis, management and current advances. Braz. J. Otorhinolaryngol. 2017, 83, 585–593, doi:10.1016/j.bjorl.2016.12.005.
20. Cerero-Lapiedra, R.; Balade-Martinez, D.; Moreno-Lopez, L.; Esparza-Gomez, G.; Bagan, J. Proliferative verrucous leukoplakia: A proposal for diagnostic criteria. Med. Oral Patol. Oral y Cir. Bucal 2010, 15, e839–e845, doi:10.4317/medoral.15.e839.
21. Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
22. Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
23. Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
24. Abadie, W.M.; Partington, E.J.; Fowler, C.B.; Schmalbach, C.E. Optimal Management of Proliferative Verrucous Leukoplakia: A Systematic Review of the Literature. Otolaryngol. – Head Neck Surg. (United States) 2015, 153, 504–511, doi:10.1177/0194599815586779.
25. Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
26. Ghazali, N.; Bakri, M.M.; Zain, R.B. Aggressive, multifocal oral verrucous leukoplakia: proliferative verrucous leukoplakia or not? J. Oral Pathol. Med. 2003, 32, 383–392, doi:10.1034/j.1600-0714.2003.00180.x.
27. Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
28. Garcia-Pola, M.; Llorente-Pendas, S.; Gonzalez-Garcia, M.; Garcia-Martin, J. The development of proliferative verrucous leukoplakia in oral lichen planus. A preliminary study. Med. Oral Patol. Oral y Cir. Bucal 2016, 21, e328–e334, doi:10.4317/medoral.20832.
29. McParland, H.; Warnakulasuriya, S. Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J. Oral Pathol. Med. 2021, 50, 229–235, doi:10.1111/jop.13129.
30. Carrard, V.C.; Brouns, E.R.E.A.; van der Waal, I. Proliferative verrucous leukoplakia; A critical appraisal of the diagnostic criteria. Med. Oral Patol. Oral Cir. Bucal 2013, 18, e411–e413, doi:10.4317/medoral.18912.
31. Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, 104550, doi:10.1016/j.oraloncology.2019.104550.
32. Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
33. Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
34. Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; MacDonald, L.C.; Worthington, H. V.; Mauleffinch, L.F. Limited evidence for interventions to treat oral leukoplakia. Evid. Based. Dent. 2017, 18, 92–93.
35. Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.







