L’Organizzazione mondiale della sanità (OMS) ha originariamente definito l’eritroplachia come qualsiasi lesione della mucosa orale che presenta placche “vellutate” di colore rosso brillante che non possono essere ricondotte clinicamente o patologicamente come qualsiasi altra condizione nota. Non esiste una definizione universalmente accettata di eritroplachia orale; tuttavia, la maggior parte delle definizioni moderne sono più o meno riduttive della definizione originale dell’OMS. La definizione più frequentemente usata nella letteratura descrive l’eritroplachia orale come una macchia rossa ardente che non può essere ricondotta clinicamente o patologicamente a qualsiasi altra lesione.
Terminologia aggiuntiva come eritroleucoplachia, leucoeritroplachia ed eritroplachia maculata sono stati usati per descrivere macchie bianche e rosse.
Eziopatogenesi
- Molti dei fattori eziologici principali nel cancro orale sono fattori contributivi o eziologici per lo sviluppo di eritroplachia.
- È stato osservato che questi fattori contribuiscono alla trasformazione maligna dell’eritroplachia orale; tuttavia, il loro ruolo nell’eziopatogenesi dell’eritroplachia è poco conosciuto.
- Questi fattori sono principalmente la masticazione delle noci di betel, la masticazione del tabacco, il fumo di tabacco e il consumo di alcol. Altri possibili fattori eziologici implicati includono l’IMC e lo stato nutrizionale
- Il papillomavirus umano (HPV) è stato definito come possibile fattore contributivo o cofattore eziologico.
Perchè tali lesioni sono rosse?
- L’analisi istopatologica rivela displasia (variabile da lieve a grave), carcinoma in situ o carcinoma a cellule squamose nel 60-90% dei casi. Tali descrizioni microscopiche spiegherebbero il colore rosso intenso delle lesioni.
- C’è mancanza di cheratina superficiale che normalmente dovrebbe disperdere e ridurre l’intensità del colore rosso.
- C’è anche una riduzione della profondità dello strato epiteliale; pertanto, la vascolarizzazione presente nel tessuto connettivo è più visibile in superficie.
- Infine, il numero di strutture vascolari sembra aumentare in risposta all’infiammazione.
Epidemiologia
- Il tasso di prevalenza varia da circa 0,02 a 2%.
- È ampiamente accettato che la prevalenza di eritroplachia sia inferiore rispetto ad altri OPDM e leucoplachia orale.
- Non sembra esserci una predilezione di genere, nonostante studi precedenti riportino una predominanza maschile.
- L’eritroplachia sembra verificarsi principalmente in media e tarda età media (Reichart e Philipsen, 2005).
- Non esiste una distribuzione geografica nota dell’eritroplachia, tuttavia, la prevalenza è notevolmente più alta nelle popolazioni con un’abitudine pre-esistente di fumare e masticare noci di betel.
Presentazione clinica
- Si presenta come una macula o macchia rosso intenso con una texture morbida e vellutata.
- In genere, l’eritroplachia è morbida alla palpazione; c’è presenza di indurimento solo nei casi di malignità.
- Le lesioni presentono di solito bordi irregolari, anche se, ben definiti. Occasionalmente, tuttavia, la superficie può apparire granulosa.
- Di solito non ci sono sintomi. I pazienti possono segnalare dolore non specifico o bruciore della zona. Inoltre, è stato segnalato sapore metallico.
Eritroleucoplachia
- Le aree rosse mostrano atrofia o assottigliamento dell’epitelio e, a differenza di eritroplachia o leucoplachia, possono presentare un margine irregolare.
- L’eritroleukoplakia è più comunemente sintomatica.
- I siti più comunemente colpiti sono il pavimento della bocca, la lingua ventrale, il palato molle, le fauci tonsillari e la mucosa buccale.
- In genere, le lesioni sono piccole (meno di 1,5 cm), anche se sono state segnalate lesioni più grandi (> 4 cm).
- Raramente l’eritroplachia colpisce più siti.
- Nei casi di trasformazione maligna, i pazienti possono presentare segni e sintomi di carcinoma squamocellulare orale (OSCC).
- Non esiste una classificazione ampiamente accettata dell’eritroplachia.
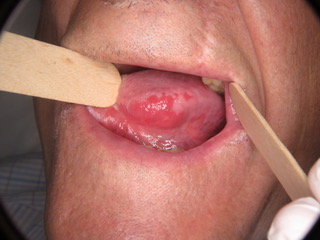
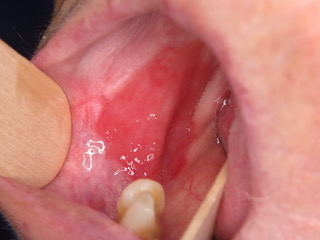
Figura 1: Eritroplachia diffusa che colpisce omogeneamente il margine laterale sinistro della lingua e l’eritroplachia omogenea che colpisce la mucosa buccale destra posteriormente.
Diagnosi differenziale
L’elenco delle diagnosi differenziali comprende quelle lesioni che presentano mucosa orale eritematosa. La candidosi eritematosa e il lichen planus atrofico sono spesso citati come i più comuni.
La candidosi eritematosa e la stomatite orale possono essere differenziate dall’eritroplachia, poiché spesso queste aree eritematose si risolvono con istruzioni di igiene dentale/ orale e trattamento con antimicotici, sia agenti sistemici che topici.
La candidosi eritematosa può presentarsi asintomatica con aree centrali eritematose che interessano il dorso della lingua, con una lesione riflessiva che colpisce il palato.
Altre infezioni microbiche, tra cui istoplasmosi e tubercolosi, possono presentarsi macchie rosse che colpiscono la mucosa orale.
Il lichen planus atrofico tende a presentarsi in modo sintomatico con caratteristiche comuni all’OLP, come per esempio striature bianche che colpiscono aree multiple della mucosa orale. Le manifestazioni orali di lupus eritematoso sistemico (SLE) si riscontrano frequentemente e possono includere eritema non specifico.
Diagnosi
- Una lesione singola con bordi ben delimitati aiuta l’odontoiatra a distinguere clinicamente eritroplachia da altri disordini.
- Queste lesioni singole possono essere rilevate incidentalmente dai dentisti generici i quali rinviano il paziente a un collega specialista.
- La biopsia d’urgenza è essenziale per escludere il cambiamento neoplastico.
- Le caratteristiche istopatologiche che possono essere rilevate sono state descritte sopra: epitelio sottile e atrofico, mancanza di cheratina e iperplasia. L’ematossilina e eosina è la colorazione più comunemente utilizzata dagli istopatologi nella diagnosi di eritroplachia.
Trasformazione maligna:
- Il tasso di trasformazione maligna varia dal 14 al 50%.
- Molte lesioni rosse possono presentarsi come carcinoma in situ o malattia invasiva al momento della diagnosi.
- La presenza di displasia da moderata a grave indica un rischio notevolmente maggiore di trasformazione maligna.
- Una recente revisione sistematica ha calcolato che il rischio complessivo di trasformazione maligna è pari al 33,1% e il tasso di trasformazione maligna all’anno è al 2,7%.
Gestione
A causa del più alto rischio di trasformazione maligna, un trattamento precoce è fondamentale.
- L’escissione chirurgica è il trattamento di scelta.
- C’è una mancanza di studi sul follow-up che segue l’escissione chirurgica ed i risultati del trattamento.
- Non ci sono linee guida sul margine esatto di escissione; questo è spesso dettato dal grado di atipia cellulare identificato.
- L’escissione laser con anidride carbonica è stata utilizzata di recente, in alternativa all’escissione con bisturi. Questo trattamento è stato associato ad una guarigione più favorevole e maggior comfort post-operatorio.
- Il tasso di recidiva dopo l’escissione è sconosciuto, tuttavia, la dimensione della lesione escissa ha dimostrato di essere un fattore predittivo significativo.
- Altre terapie tra cui la vitamina A, i retinoidi, la bleomicina e il tè misto non hanno dato risultati favorevoli per sostenere il loro impiego.
- Si dovrebbe raccomandare la cessazione delle abitudini ricreative associate a un rischio più elevato di trasformazione maligna.
Follow-up:
- Non c’è un intervallo di follow-up suggerito per l’eritroplachia.
- Un aumento delle dimensioni, abitudini ricreative ad alto rischio (fumo/alcol), siti ad alto rischio (ventre linguale e pavimento della bocca), un cambiamento nell’aspetto clinico e lo sviluppo di sintomi possono dettare una nuova biopsia della lesione.
- Una fotografia clinica scattata agli appuntamenti successivi è utile per valutare oggettivamente eventuali cambiamenti nell’aspetto della lesione.
Sommario
La definizione più ampiamente accettata di eritroplachia è “qualsiasi lesione della mucosa orale che si presenta come placche vellutate di colore rosso vivo che non possono essere caratterizzate clinicamente o patologicamente come qualsiasi altra condizione nota”. Il fumo, l’alcol, la masticazione di noci di betel e le mutazioni genetiche possono giocare un ruolo nell’eziologia. L’eritroplachia è l’OPMD con il più basso tasso di prevalenza e il più alto tasso di trasformazione maligna. Considerando l’alto tasso di trasformazione maligna, la biopsia incisionale precoce è consigliata per identificare i cambiamenti neoplastici precoci. Il trattamento di scelta per le lesioni ad alto rischio (displasia grave e carcinoma in situ) è l’escissione chirurgica. È necessario un follow-up regolare e la soglia per ri-biopsiare il sito è bassa.
Nonostante il più alto tasso di trasformazione maligna tra gli OPMD, l’eritroplachia rimane l’OPMD più scarsamente compreso. La mancanza di ricerca lascia molte domande senza risposta per quanto riguarda l’eziologia, la prevalenza, la diagnosi e la gestione dell’eritroplachia.
Riferimenti e ulteriori letture
J.J. Pindborg, P.A. Reichart, C.J. Smith, I. van der Waal, in collaboration with Sobin LH and pathologists in 9 countries. Histological typing of cancer and precancer of the oral mucosa
(2nd ed.), Springer Verlag, Berlin, New York, Tokyo (1997)
C. Scully Oral and maxillofacial medicine the basis of diagnosis and treatment, Wright. Elsevier Science Ltd., Edinburgh, London, New York (2004), pp. 289-290
J. PHILIP SAPP DDS, MS, … GEORGE P. WYSOCKI DDS, PHD, in Contemporary Oral and Maxillofacial Pathology (Second Edition), 2004
Abati, S., Bramati, C., Bondi, S., Lissoni, A. and Trimarchi, M. (2020) ‘Oral Cancer and Precancer: A Narrative Review on the Relevance of Early Diagnosis’, Int J Environ Res Public Health, 17(24).
Al-Attas, S. A., Ibrahim, S. S., Amer, H. A., Darwish, Z. l.-S. and Hassan, M. H. (2014) ‘Prevalence of potentially malignant oral mucosal lesions among tobacco users in Jeddah, Saudi Arabia’, Asian Pac J Cancer Prev, 15(2), pp. 757-62.
Bouquot, J. E. and Ephros, H. (1995) ‘Erythroplakia: the dangerous red mucosa’, Pract Periodontics Aesthet Dent, 7(6), pp. 59-67; quiz 68.
Fatahzadeh, M. and Schwartz, R. A. (2013) ‘Oral Kaposi’s sarcoma: a review and update’, Int J Dermatol, 52(6), pp. 666-72.
Ferreira, A. M., de Souza Lucena, E. E., de Oliveira, T. C., da Silveira, É., de Oliveira, P. T. and de Lima, K. C. (2016) ‘Prevalence and factors associated with oral potentially malignant disorders in Brazil’s rural workers’, Oral Dis, 22(6), pp. 536-42.
Hashibe, M., Mathew, B., Kuruvilla, B., Thomas, G., Sankaranarayanan, R., Parkin, D. M. and Zhang, Z. F. (2000) ‘Chewing tobacco, alcohol, and the risk of erythroplakia’, Cancer Epidemiol Biomarkers Prev, 9(7), pp. 639-45.
Holmstrup, P. (2018) ‘Oral erythroplakia-What is it?’, Oral Dis, 24(1-2), pp. 138-143.
Holmstrup, P. and Pindborg, J. J. (1979) ‘Erythroplakic lesions in relation to oral lichen planus’, Acta Derm Venereol Suppl (Stockh), 59(85), pp. 77-84.
Iocca, O., Sollecito, T. P., Alawi, F., Weinstein, G. S., Newman, J. G., De Virgilio, A., Di Maio, P., Spriano, G., Pardiñas López, S. and Shanti, R. M. (2020) ‘Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype’, Head Neck, 42(3), pp. 539-555.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Kramer, I. R., Lucas, R. B., Pindborg, J. J. and Sobin, L. H. (1978) ‘Definition of leukoplakia and related lesions: an aid to studies on oral precancer’, Oral Surg Oral Med Oral Pathol, 46(4), pp. 518-39.
Lumerman, H., Freedman, P. and Kerpel, S. (1995) ‘Oral epithelial dysplasia and the development of invasive squamous cell carcinoma’, Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 79(3), pp. 321-9.
Mello, F. W., Miguel, A. F. P., Dutra, K. L., Porporatti, A. L., Warnakulasuriya, S., Guerra, E. N. S. and Rivero, E. R. C. (2018) ‘Prevalence of oral potentially malignant disorders: A systematic review and meta-analysis’, J Oral Pathol Med, 47(7), pp. 633-640.
MERRICKS, J. W. and COTTRELL, T. L. (1953) ‘Erythroplasia of Queyrat’, J Urol, 69(6), pp. 807-13.
Nielsen, H., Norrild, B., Vedtofte, P., Praetorius, F., Reibel, J. and Holmstrup, P. (1996) ‘Human papillomavirus in oral premalignant lesions’, Eur J Cancer B Oral Oncol, 32B(4), pp. 264-70.
O’Sullivan, E. M. (2011) ‘Prevalence of oral mucosal abnormalities in addiction treatment centre residents in Southern Ireland’, Oral Oncol, 47(5), pp. 395-9.
PINDBORG, J. J., RENSTRUP, G., POULSEN, H. E. and SILVERMAN, S. (1963) ‘STUDIES IN ORAL LEUKOPLAKIAS. V. CLINICAL AND HISTOLOGIC SIGNS OF MALIGNANCY’, Acta Odontol Scand, 21, pp. 407-14.
Reichart, P. A. and Philipsen, H. P. (2005) ‘Oral erythroplakia–a review’, Oral Oncol, 41(6), pp. 551-61.
Roza, A. L. O. C., Kowalski, L. P., William, W. N., de Castro, G., Chaves, A. L. F., Araújo, A. L. D., Ribeiro, A. C. P., Brandão, T. B., Lopes, M. A., Vargas, P. A., Santos-Silva, A. R. and Cancer, L. A. C. O. G. B. G. o. H. a. N. (2021) ‘Oral leukoplakia and erythroplakia in young patients: a systematic review’, Oral Surg Oral Med Oral Pathol Oral Radiol, 131(1), pp. 73-84.
Shafer, W. G. and Waldron, C. A. (1975) ‘Erythroplakia of the oral cavity’, Cancer, 36(3), pp. 1021-8.
Shear, M. (1972) ‘Erythroplakia of the mouth’, Int Dent J, 22(4), pp. 460-73.
Thavarajah, R., Rao, A., Raman, U., Rajasekaran, S. T., Joshua, E., R, H. and Kannan, R. (2006) ‘Oral lesions of 500 habitual psychoactive substance users in Chennai, India’, Arch Oral Biol, 51(6), pp. 512-9.
Villa, A., Villa, C. and Abati, S. (2011) ‘Oral cancer and oral erythroplakia: an update and implication for clinicians’, Aust Dent J, 56(3), pp. 253-6.
Warnakulasuriya, S. (2018) ‘Clinical features and presentation of oral potentially malignant disorders’, Oral Surg Oral Med Oral Pathol Oral Radiol, 125(6), pp. 582-590.
Yang, S. W., Lee, Y. S., Chang, L. C., Hsieh, T. Y. and Chen, T. A. (2015a) ‘Outcome of excision of oral erythroplakia’, Br J Oral Maxillofac Surg, 53(2), pp. 142-7.
Yang, S. W., Lee, Y. S., Chang, L. C., Hwang, C. C., Luo, C. M. and Chen, T. A. (2015b) ‘Clinical characteristics of narrow-band imaging of oral erythroplakia and its correlation with pathology’, BMC Cancer, 15, pp. 406.
Zaini, Z. M., McParland, H., Møller, H., Husband, K. and Odell, E. W. (2018) ‘Predicting malignant progression in clinically high-risk lesions by DNA ploidy analysis and dysplasia grading’, Sci Rep, 8(1), pp. 15874.







