Leucoplachia
Diverse definizioni sono state proposte per la leucoplachia orale (OL) e questa si è continuamente evoluta negli ultimi 40 anni (Tabella 1). La definizione più recente e ampiamente accettata è stata proposta dal WHO Collaborating Centre for Oral Cancer nel 2007 e riconfermata nel 2020. La leucoplachia è definita come “Una placca prevalentemente bianca di rischio discutibile avendo escluso (altre) malattie o disturbi noti che non comportano un aumento del rischio di cancro”.
Il termine leucoplachia viene utilizzato quando è stata esclusa qualsiasi altra condizione della mucosa orale che può presentarsi come una lesione bianca (ad esempio cheratosi da attrito, lichen planus, nevo bianco spongioso, leucoplachia capelluta ecc.). Per definizione la leucoplachia è un’entità clinica, diagnosticata per esclusione e non ha una componente istopatologica specifica.
Epidemiologia e fattori di rischio per lo sviluppo della leucoplachia orale
Epidemiologia:
- Comunemente diagnosticato in pazienti di mezza età o anziani.
- Più comunemente identificato nei maschi.
- L’OL è sei volte più comune tra i fumatori che tra i non fumatori.
- La prevalenza dell’OL varia significativamente con le variazioni geografiche a causa di fattori di rischio differenti, come la masticazione delle noci di betel nel sud-est asiatico.
Fattori di rischio:
- L’OL è associato a vari fattori di rischio, simili a quelli osservati nel cancro orale, come il tabacco (sia fumato che senza fumo), il forte consumo di alcol, la masticazione di betel quid (soprattutto nei paesi dell’Asia meridionale) e, per le lesioni che coinvolgono il labbro, l’esposizione alla luce ultravioletta (UV).
- Il consumo di alcol è un fattore di rischio indipendente. È stato stabilito che questi fattori possono avere un ruolo eziologico nello sviluppo dell’OL in più del 75% degli individui colpiti.
Presentazione clinica
- L’OL può insorgere ovunque nella cavità orale e può essere uni- o multifocale. Tuttavia, nelle popolazioni occidentali industrializzate, i siti coinvolti più frequentemente sono il margine della lingua e il pavimento della bocca.
- Nelle popolazioni asiatiche, a causa del frequente consumo di betel quid, la mucosa buccale e quella labiale sono spesso colpite.
- Clinicamente, la leucoplachia presenta caratteristiche variabili nell’aspetto (bianco, rosso, e misto bianco e rosso, placca/plateau granulare, atrofica), nella consistenza (liscia, corrugata, verrucosa granulare, morbida, tonica o dura), nelle dimensioni e nella forma.
- L’estensione clinica della leucoplachia orale può variare in dimensioni da una lesione relativamente piccola e ben circoscritta ad una estesa che coinvolge una vasta area della mucosa orale.
La leucoplachia può essere sottoclassificata clinicamente in due tipi: omogenea e non omogenea. Figure 1 e 2.
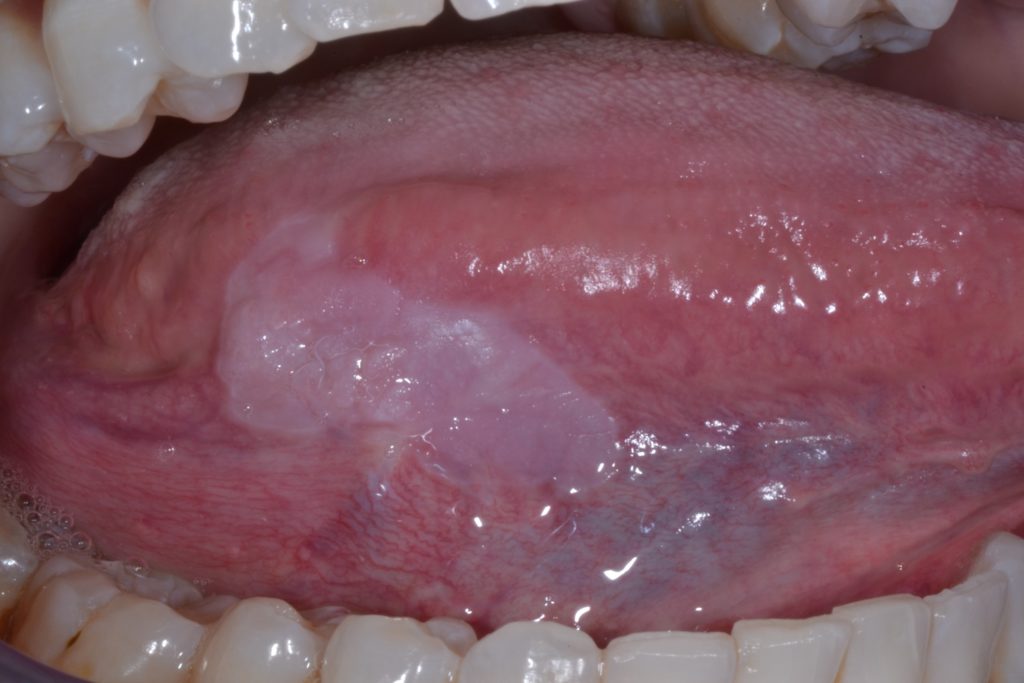
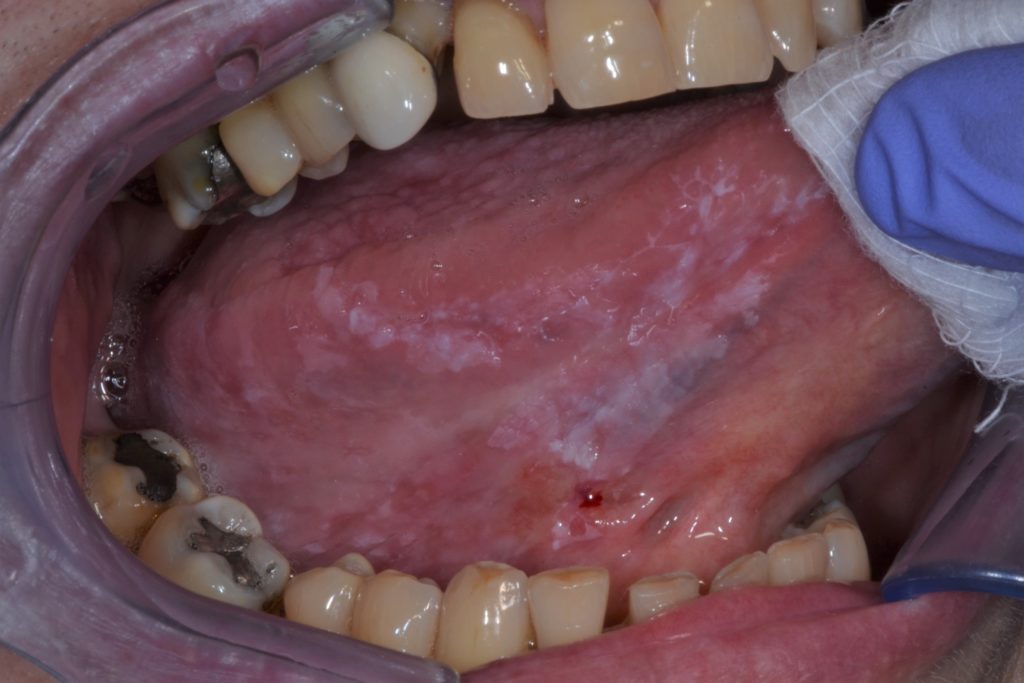
Questa distinzione è puramente clinica, basata su caratteristiche distinte come superficie, colore e consistenza: leucoplachia omogenea e leucoplachia non omogenea (tabella 2).
| Leucoplachia orale | |
| Leucoplachia omogenea | Leucoplachia non omogenea |
| Lesione bianca uniforme e sottile con margini ben definiti, superficie liscia associata a crepe/fessure poco profonde. Non asportabile. | Maculato: colore misto bianco e rosso Nodulare: piccole escrescenze polipoidi, arrotondate, rosse o bianche Verruche o esofitiche: superficie rugosa o corrugata. Non asportabile. |
Tabella 2: Classificazione della leucoplachia orale basata sulle caratteristiche cliniche distinte
Leucoplachia omogenea
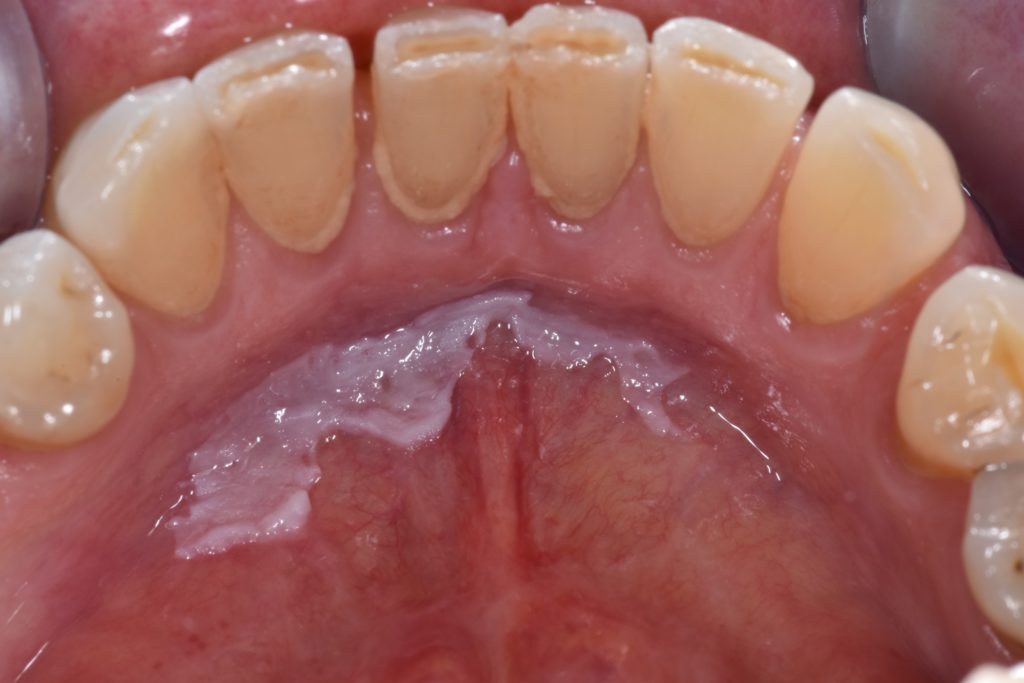
- Caratterizzata da una macchia/placca bianca, piana e uniforme con margini ben definiti e superficie liscia che può essere associata a fessure poco profonde della cheratina superficiale. Illustrato ulteriormente nella Figura 3.
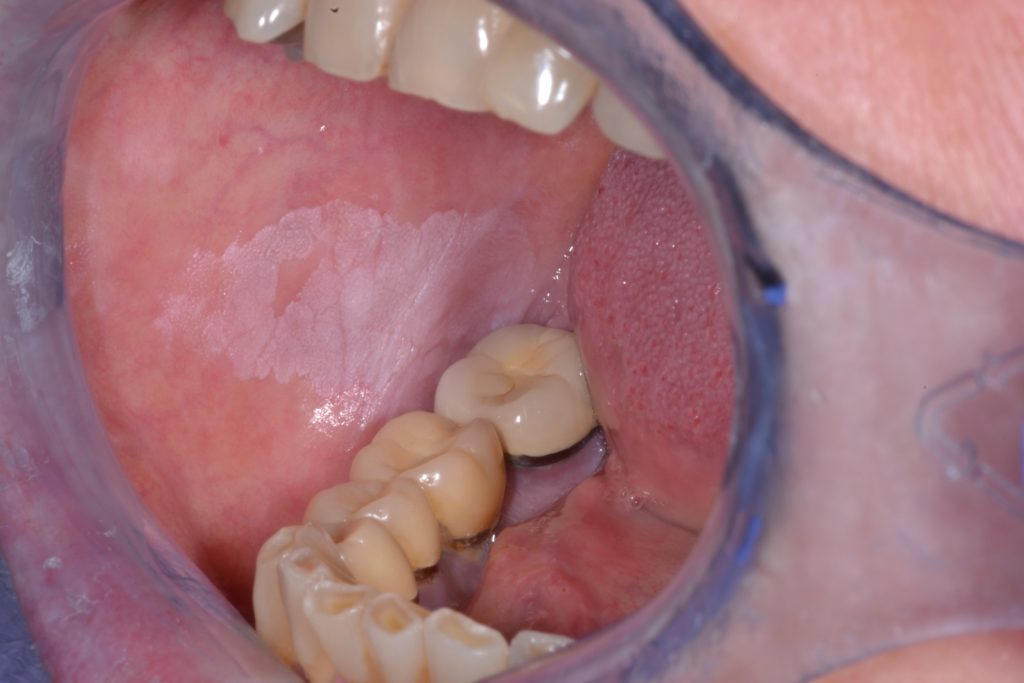
Leucoplachia non omogenea
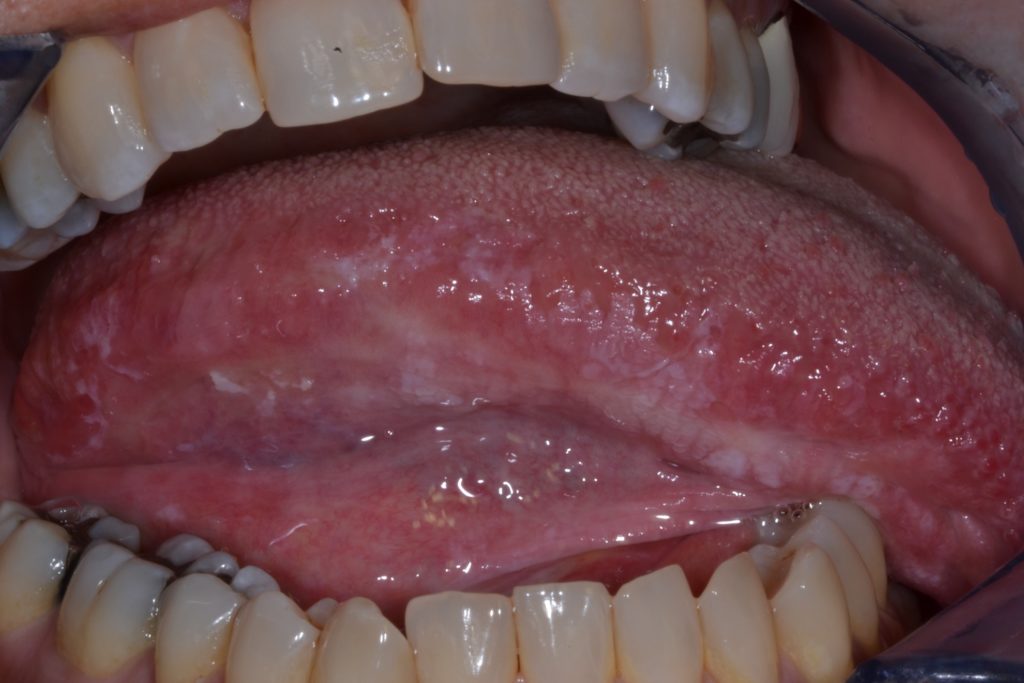
- Caratterizzata da una consistenza irregolare, che può includere ulcerazioni focali superficiali e margini poco definiti. Le leucoplachie non omogenee possono essere associate a diversi quadri clinici utilizzati per la loro descrizione: illustrato ulteriormente nella Figura 4 e 5.
- Maculato: colore misto bianco e rosso, ma mantenendo una colorazione prevalentemente bianca (definita anche come eritroleucoplachia)
- Nodulare: piccole proiezioni polipoidi, arrotondate, escrescenze rosse o bianche
- Verrucoso o esofitico: aspetto superficiale rugoso o corrugato
- Le leucoplachie sono generalmente asintomatiche e sono spesso identificate durante una visita odontostomatologica di controllo.
- Le leucoplachie omogenee sono tipicamente asintomatiche.
- I sintomi sono rari e, se presenti, sono solitamente associati alle forme non omogenee che possono mostrare un’ulcerazione superficiale focale.
- I sintomi più frequentemente riportati sono il disagio, il formicolio e la sensibilità al tatto, alle bevande calde o ai cibi piccanti.
Rischio di insorgenza del cancro
Carcinoma orale a cellule squamose:
- Il carcinoma squamocellulare orale è la neoplasia più comune che colpisce il cavo orale.
- L’OSCC colpisce tipicamente i maschi oltre i 60 anni, tuttavia, recentemente la prevalenza è aumentata in quelli più giovani di 40 anni.
- L’OSCC può presentarsi come un’ulcera che non guarisce, una neoformazione in crescita con superficie irregolare e lesioni rosse o bianche dell’epitelio orale.
Leucoplachia
- Le leucoplachie sono classificate come disordini orali potenzialmente maligni che predispongono gli individui affetti a un rischio aumentato di sviluppo di un carcinoma a cellule squamose orale.
- OL mostra percentuali di progressione a OSCC che variano dallo 0% al 36,4%. Il tasso annuale di trasformazione varia dallo 0,3% al 6,9% all’anno come riportato da una recente revisione di studi osservazionali.
- I fattori di rischio, che hanno mostrato significatività statistica, per lo sviluppo del cancro negli individui affetti da OL sono elencati nella tabella 4.
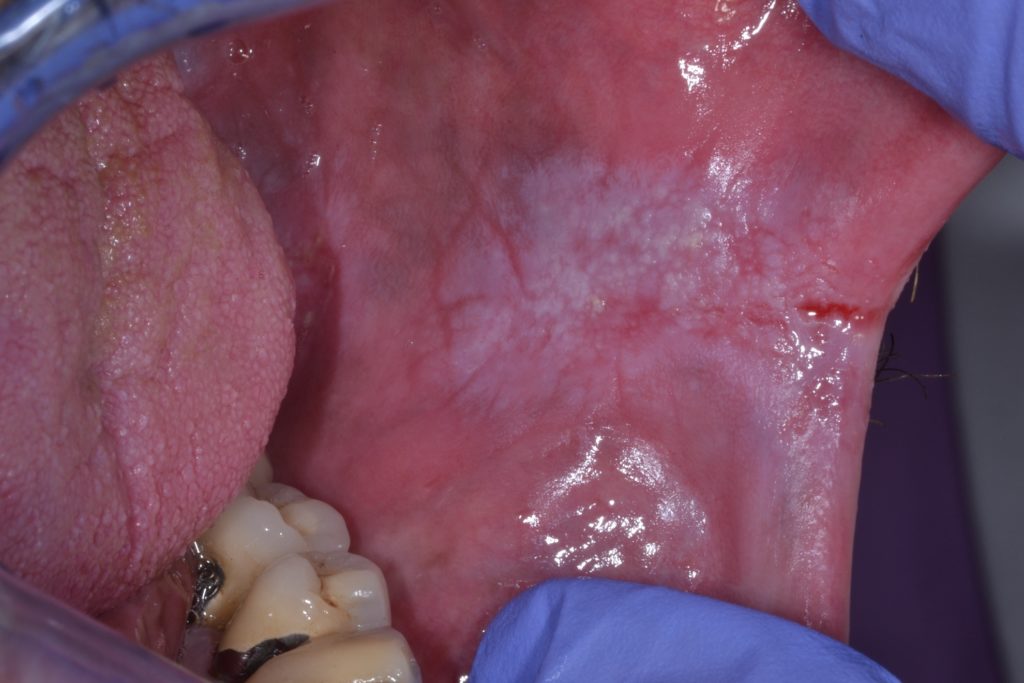
- La figura 6 illustra una leucoplachia del pavimento della bocca che è considerato un sito ad alto rischio a causa dell’elevato numero di agenti cancerogeni che agiscono su questo sito.
| Leucoplachia orale – fattore di rischio di trasformazione maligna |
| Aspetto clinico non omogeneo |
| Sesso femminile |
| Leucoplachia di lunga durata |
| Leucoplachia idiopatica (stato di non fumatore/non bevitore/non masticatore di noci di betel) |
| Posizione: margine linguale e/o pavimento della bocca |
| Dimensione > 200 mm2 |
| Presenza di displasia epiteliale |
| Presenza di Candida Albicans (candidosi iperplastica cronica o leucoplachia da candida) [35] |
Tabella 3. Fattori di rischio di trasformazione maligna per la leucoplachia orale
Trasformazione da leucoplachia orale a cancro orale
- Le leucoplachie con diverse caratteristiche cliniche, istologiche o molecolari possono avere diversi rischi di trasformarsi in OSCC.
- Le leucoplachie non omogenee comportano un rischio maggiore di sviluppo di OSCC rispetto alle leucoplachie omogenee – è presente un rischio di circa 7 volte maggiore per lo sviluppo maligno con leucoplachie non omogenee rispetto alle leucoplachie omogenee e un rischio 5 volte maggiore quando la dimensione della lesione è maggiore di 200 mm2
- Nelle popolazioni occidentali, le femmine anziane con leucoplachia idiopatica di lunga data, senza fattori di rischio, paradossalmente, hanno un aumentato rischio di progressione verso il cancro probabilmente dovuto a un fattore di rischio endogeno piuttosto che a fattori ambientali.
- L’arrossamento in una lesione OL (lesione non omogenea) indica una potenziale colonizzazione da parte di specie di Candida e anche un aumento del rischio di displasia e/o malignità.
- Il grado di displasia è accettato come un forte predittore della futura trasformazione maligna in OL e rimane il miglior indicatore per valutare il rischio di sviluppo del cancro orale.
- Le leucoplachie non omogenee presentano più spesso una displasia grave o un OSCC superficialmente invasivo al momento della biopsia incisionale diagnostica.
- Il rischio di sviluppo del cancro è strettamente legato al tipo di lesione e al grado di displasia.
Diagnosi della leucoplachia
Un esame obiettivo intraorale, con palpazione dei linfonodi cervicali, è tassativo [5]. Come descritto sopra, il termine leucoplachia è una diagnosi clinica che ha escluso altre lesioni bianche o bianco/rosse clinicamente riconoscibili. I seguenti criteri dovrebbero essere considerati quando si fa una diagnosi clinica di leucoplachia orale:
- macchia/placca bianca che non può essere asportata
- la leucoplachia omogenea ha solitamente bordi ben delimitati
- la leucoplachia non omogenea presenta spesso componenti rosse o nodulari e bordi più sfumati
- nessuna prova di correlazione con un traumatismo cronico locale
- non è reversibile dopo aver rimosso l’apparente causa traumatica locale
- non scompare quando si distende il tessuto
- esclusione di altre lesioni bianche o bianco/rosse
Carrard e Van der Waal hanno recentemente proposto una lista di parametri, alcuni dei quali sono riportati nella tabella, che possono essere rilevanti quando si stabilisce una diagnosi clinica di leucoplachia orale (Tabella 4).
| Caratteristica | Ruolo e rilevanza nella diagnosi clinica della leucoplachia orale . |
| Età | OL si verifica raramente nei primi due decenni di vita. |
| Storia medica | Importante per la diagnosi di diverse malattie simili alla leucoplachia, come le manifestazioni orali delle genodermatosi, la sifilide e l’infezione da HIV. |
| Abitudini al tabacco di ogni tipo | Più comune nei consumatori di tabacco |
| Sintomi | La maggior parte delle OL sono asintomatiche, ma potrebbero presentarsi dolore o prurito. |
| Insorgenza della malattia | OL insorgono lentamente, nel corso di diversi mesi o anni. |
| Decorso della malattia | OL ha un decorso clinico stabile |
| Morfologia | |
| Dimensione | Le dimensioni non sono rilevanti ai fini di una diagnosi clinica di OL. |
| Colore | Il colore può variare da un bianco omogeneo a un aspetto misto bianco e rosso. |
| Superficie | La superficie può variare da liscia, rugosa a verrucosa. L’ulcerazione può essere indicativa di malignità. |
| Indurimento alla palpazione | La palpazione è uno strumento diagnostico molto importante, essendo l’indurimento un segno di potenziale natura maligna. |
Tabella 4: Una lista di alcune caratteristiche, modificata da Carrard e van der Waal, che possono essere utili nella diagnosi clinica e nella valutazione della leucoplachia
- La procedura gold standard per confermare la diagnosi clinica di leucoplachia orale è quella di eseguire una biopsia incisionale rappresentativa della lesione e inviare il campione per l’analisi istopatologica.
- La biopsia diagnostica è obbligatoria per confermare o smentire la diagnosi di OL. La biopsia e il successivo esame istopatologico permettono di escludere altre patologie che possono presentarsi come una macchia bianca e di valutare la colonizzazione della candida nell’epitelio.
- La biopsia è necessaria per escludere la diagnosi di carcinoma squamoso orale (OSCC) e per valutare la presenza e il grado di displasia epiteliale.
- I risultati istopatologici associati alla leucoplachia orale possono variare dalla semplice iperplasia epiteliale con iper-paracheratosi o iper(orto)cheratosi, la presenza o l’assenza e il grado di displasia epiteliale.
Sebbene sia stata proposta una classificazione binaria per la displasia orale (basso grado e alto grado), il sistema a tre gradi (lieve, moderato o grave) è ancora ampiamente utilizzato nella pratica clinica in tutto il mondo.
Diagnosi differenziale delle lesioni bianche
Durante l’esame clinico di una lesione bianca, è importante valutare qualsiasi potenziale causa traumatica locale e, se identificata, la chiazza bianca dovrebbe essere denominata come cheratosi da attrito. La cheratosi da attrito non è considerata un OPMD e, rimuovendo la causa di attrito, dovrebbe risolversi.
Nella tabella seguente è presente un elenco dettagliato delle lesioni bianche più rilevanti e dei disturbi che dovrebbero essere esclusi prima di fare una diagnosi clinica di leucoplachia orale (Tabella 5).
| Diagnosi differenziale con OL | Descrizione |
| Nevo bianco spongioso | Noto nell’infanzia, spesso in anamnesi familiare, presentazione bilaterale, spesso esteso nella bocca, la mucosa genitale può essere colpita. |
| Linea alba | La diagnosi è clinica, quasi sempre bilaterale lungo il piano dell’occlusione |
| Leucoedema | Diagnosi clinica con un aspetto simile a un velo bilaterale sulla mucosa buccale e scompare stirando i tessuti. Predilezione tra alcuni gruppi razziali: persone di mezza età con pelle scura. |
| Granuli di Fordyce | Macchie/papule di 1-2 mm di diametro nettamente delimitate dalla normale mucosa di rivestimento circostante, elevate, circolari, di colore bianco o giallo-bianco |
| Morsicatio buccarum | Una condizione caratterizzata da irritazione o lesione cronica della mucosa buccale, delle commessure o delle guance causata dalla masticazione o dal morso abituale e ripetitivo. Si osservano squame irregolari biancastre-giallastre con bordi frastagliati; spesso bilaterali. |
| Cheratosi frizionale | Storia clinica positiva per attrito o altri traumi meccanici. Per lo più reversibile dopo la rimozione della causa eziologica. |
| Lesioni cheratosiche | Includono: cheratosi nei fumatori invertiti, cheratosi della cresta alveolare (ARK), cheratosi da attrito, cheratosi associata a sanguinaria, cheratosi indotta dal tabacco senza fumo e cheratosi di significato sconosciuto (KUS). La cheratosi da fumo invertito e la cheratosi indotta dal tabacco senza fumo hanno un potenziale maligno. |
| Lesione chimica | Storia di esposizione prolungata a un agente chimico (ad esempio, una compressa di aspirina) o a un agente caustico (ad esempio, ipoclorito di sodio). La lesione è dolorosa, ma di solito si risolve rapidamente. |
| Stomatite da nicotina (palato del fumatore) | Palato bianco-grigiastro con macchie rosse legate a ghiandole salivari minori infiammate. Di solito, una diagnosi clinica associata alla storia del fumo. |
| Stomatite uremica | Placche di essudato fibrinoso bianche, nettamente demarcate e aderenti con alcune cellule epiteliali desquamate. La diagnosi è associata a un’anamnesi positiva per una malattia renale. |
| Cheilite attinica | Il labbro inferiore è l’area più colpita con lesioni bianche. La presentazione clinica tipica può variare e possono verificarsi cambiamenti simili alla leucoplachia. |
| Lichen planus orale (OLP) | Nelle forme tipiche, le papule bianche si uniscono in linee per formare un aspetto clinico reticolare sulla superficie mucosa variamente infiammata. Presentazione spesso bilaterale. L’OLP può anche presentarsi come gengivite desquamativa. Possono presentarsi diversi sottotipi clinici di lichen planus: Reticolare: linee bianche simili a merletti Lineare, anulare, papulare: varie presentazioni come linee, anelli o punti bianchi Tipo a placca: macchia bianca con striature ai margini Atrofico e ulcerativo: rosso e francamente ulcerato Bolloso: vescicolare L’OLP a placche può essere molto difficile da distinguere dalla leucoplachia orale. L’OLP è inclusa nel gruppo dei disturbi orali potenzialmente maligni [1] |
| Lesione lichenoide da contatto diretto | Causata da un contatto diretto prolungato della mucosa orale con un’amalgama o altri tipi di restauro. La lesione dovrebbe scomparire in un periodo arbitrariamente scelto di 2-3 mesi dopo la rimozione del restauro. |
| Candidiasi pseudomembranosa acuta | Infezione generalmente diffusa della mucosa orale e talvolta orofaringea. La membrana bianca può essere raschiata via rivelando a volte un’impronta eritematosa/strisciata. Associata a cause locali (per esempio, steroidi spray inalati) o sistemiche (per esempio, immunodeficienza) |
| Candidosi iperplastica cronica (leucoplachia candida) | Una macchia aderente, bianca o bianca e rossa causata da un’infezione fungina cronica, di solito Candida Albicans. Principalmente localizzata nella zona delle retrocommessure, spesso bilaterale. Il trattamento antimicotico è utilizzato per valutare la regressione delle lesioni e stabilire la diagnosi. |
| Leucoplachia cappelluta | Cheratosi con striature verticali, causata dal virus opportunistico Epstein Bar, spesso bilaterale e più comune sui bordi laterali della lingua. Storia di immunosoppressione per malattia da HIV o farmaci (ad esempio, dopo un trapianto d’organo/ steroidi a lungo termine). |
| Sifilide secondaria | La diagnosi dovrebbe esaminare la storia medica del paziente e dimostrare la positività sierologica per il Treponema Pallidum. La presentazione clinica può essere varia: lesioni lichenoidi multiple e biancastre, alterazioni della mucosa orale simili alla leucoplachia o lesioni rosse multiple sul dorso linguale e sul palato |
| Papilloma e lesioni legate all’HPV (per esempio, condiloma acuminato, iperplasia epiteliale multifocale, verruca vulgaris) | La diagnosi si basa sull’aspetto clinico delle lesioni e sull’anamnesi. Una biopsia, associata alla tipizzazione dell’HPV, è solitamente utile. |
Tabella 5 Una lista dettagliata delle principali lesioni bianche, condizioni o malattie che dovrebbero essere escluse prima di fare una diagnosi clinica di leucoplachia orale (modificata da [1,9])
Gestione della leucoplachia orale
L’obiettivo primario nella gestione della leucoplachia orale dovrebbe essere quello di monitorare e prevenire l’insorgenza del cancro orale. Nel tentativo comune di ridurre le possibilità di sviluppo in cancro, sono stati proposti diversi trattamenti e protocolli di gestione. I principali approcci nella gestione dell’OL possono essere suddivisi in tre gruppi:
- trattamento medico (topico o sistemico)
- osservazione clinica ( “wait and see”: nessun intervento, ma stretta sorveglianza clinica e istologica)
- chirurgia: eseguita con diverse tecniche (bisturi, chirurgia laser, escissione e vaporizzazione, criochirurgia)
Non c’è consenso unanime sull’approccio più appropriato per OL.
Trattamento medico
Nessuno dei trattamenti medici e complementari studiati (vitamina A, beta carotene, bleomicina) ha dimostrato di essere efficace nel prevenire l’insorgenza del cancro negli individui con OL. Inoltre, diversi studi sulla chemio-prevenzione hanno mostrato una notevole tossicità dei farmaci utilizzati. Il trattamento medico della leucoplachia può essere efficace nel ridurre o risolvere la leucoplachia orale nel breve termine, ma è stato associato a un alto rischio di recidiva. L’uso di agenti chemiopreventivi in studi clinicamente controllati non hanno ancora dimostrato la loro efficacia nella prevenzione della trasformazione maligna e della successiva recidiva.
Approccio “wait and see”
Un altro approccio può essere quello di tenere una leucoplachia sotto stretta sorveglianza clinica e istologica, con frequenti visite cliniche (esami) e biopsie con lo scopo di rilevare la trasformazione maligna il più presto possibile, fornendo così la migliore prognosi possibile. Questo approccio si basa sul concetto di “cancerizzazione di campo”, proposto da Slaughter nel 1957, secondo il quale se un agente cancerogeno ha portato a un cambiamento premaligno o maligno clinicamente rilevabile in una parte del cavo orale, esiste un rischio uguale per le altre parti del cavo orale a causa di un effetto di campo. L’OL può essere considerato un indicatore di rischio per l’intera mucosa orale piuttosto che per un’area specifica. Un recente RCT ha valutato l’efficacia dell’escissione chirurgica rispetto alla cura standard nella prevenzione dell’OSCC in 260 soggetti con OL non displastica. Due pazienti, uno in ciascun braccio, hanno sviluppato l’OSCC e gli autori hanno concluso che il regolare follow-up clinico potrebbe essere considerato uno standard di cura affidabile tra i pazienti con OL non displastiche.
Chirurgia
Esiste un solo studio controllato randomizzato (RCT) che ha confrontato l’effetto dell’escissione chirurgica contro nessun trattamento o placebo. Nonostante questo, i trattamenti chirurgici sono la prima scelta nella gestione della leucoplachia orale per la maggior parte dei clinici. L’escissione chirurgica viene eseguita frequentemente e ci sono alcune prove che suggeriscono che questo riduce il rischio di trasformazione maligna rispetto alla sorveglianza attiva. Solo i dati provenienti da studi osservazionali hanno confrontato i tassi di incidenza del cancro nelle persone che si sono sottoposte o meno al trattamento chirurgico per le leucoplachie orali con differenze nei criteri diagnostici di inclusione, negli intervalli di follow-up, nelle caratteristiche dei partecipanti e nelle tecniche chirurgiche utilizzate. Questi studi hanno mostrato risultati molto variabili e le loro conclusioni erano contrastanti.
L’intervento chirurgico con l’escissione a lama fredda e/o il laser CO2 viene solitamente eseguito per leucoplachie non omogenee o eritroplachie che sono associate a displasia da moderata a grave.
Conclusione
La chirurgia rimane l’opzione di trattamento preferita dai più, tuttavia l’efficacia della chirurgia rispetto alla regolare osservazione clinica non è stata valutata in RCT per la prevenzione dello sviluppo del cancro. Ad oggi, solo un RCT ha confrontato i trattamenti chirurgici con nessun trattamento. In assenza di solidi RCT, la pratica clinica continua a variare.
Riferimenti bibliografici e ulteriori letture
Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
van der Waal, I. Oral leukoplakia, the ongoing discussion on definition and terminology. Med. Oral Patol. Oral Cir. Bucal 2015, 20, e685–e692, doi:10.4317/medoral.21007.
Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; Macdonald, L.C.I.; Worthington, H. V. Interventions for treating oral leukoplakia to prevent oral cancer. Cochrane Database Syst. Rev. 2016.
Amagasa, T.; Yamashiro, M.; Uzawa, N. Oral premalignant lesions: From a clinical perspective. Int. J. Clin. Oncol. 2011, 16, 5–14, doi:10.1007/s10147-010-0157-3.
Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental
Speight, P.M.; Khurram, S.A.; Kujan, O. Oral potentially malignant disorders: risk of progression to malignancy. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018.
Napier, S.S.; Speight, P.M. Natural history of potentially malignant oral lesions and conditions: An overview of the literature. J. Oral Pathol. Med. 2008, 37, 1–10.
Carrard, V.; van der Waal, I. A Clinical Diagnosis of Oral Leukoplakia . Med Oral Patol Oral Cir Bucal 2018.
Sundberg, J.; Korytowska, M.; Holmberg, E.; Bratel, J.; Wallström, M.; Kjellström, E.; Blomgren, J.; Kovács, A.; Öhman, J.; Sand, L.; et al. Recurrence rates after surgical removal of oral leukoplakia-A prospective longitudinal multicentre study. PLoS One 2019, 14, doi:10.1371/journal.pone.0225682.
Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003,
Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
Mello, F.W.; Miguel, A.F.P.; Dutra, K.L.; Porporatti, A.L.; Warnakulasuriya, S.; Guerra, E.N.S.; Rivero, E.R.C. Prevalence of oral potentially malignant disorders: A systematic review and
Jayasooriya, P.R.; Dayaratne, K.; Dissanayake, U.B.; Warnakulasuriya, S. Malignant transformation of oral leukoplakia: a follow-up study. Clin. Oral Investig. 2020, doi:10.1007/s00784-020-03322-4.
Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, doi:10.1016/j.oraloncology.2019.104550.
Arduino, P.; Bagan, J.; El-Naggar, A.; Carrozzo, M. Urban legends series: Oral leukoplakia. Oral Dis. 2013, 19, 642–659.
Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
Syrjänen, S.; Lodi, G.; von Bültzingslöwen, I.; Aliko, A.; Arduino, P.; Campisi, G.; Challacombe, S.; Ficarra, G.; Flaitz, C.; Zhou, H.; et al. Human papillomaviruses in oral carcinoma and oral potentially malignant disorders: A systematic review. Oral Dis. 2011, 17, 58–72, doi:10.1111/j.1601-0825.2011.01792.x.
Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2020, odi.13622, doi:10.1111/odi.13622.
Awadallah, M.; Idle, M.; Patel, K.; Kademani, D. Management update of potentially premalignant oral epithelial lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 628–636.
Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncol. 2010, 46, 423–425.
Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, doi:10.1016/0030-4220(85)90313-5.
Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760,
Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9.
Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2020, 105121, doi:10.1016/j.oraloncology.2020.105121.
Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
Lombardi, N.; Sorrentino, D.; D’amore, F.; Moneghini, L.; Franchini, R.; Sardella, A. Oral erythroleukoplakia on the lateral border of the tongue in a young patient. Dent. Cadmos 2020, 88, 277–278, doi:10.19256/d.cadmos.05.2020.03.
Warnakulasuriya, S.; Ariyawardana, A. Malignant transformation of oral leukoplakia: A systematic review of observational studies. J. Oral Pathol. Med. 2016, 45, 155–166, doi:10.1111/jop.12339.
Ho, M.W.; Risk, J.M.; Woolgar, J.A.; Field, E.A.; Field, J.K.; Steele, J.C.; Rajlawat, B.P.; Triantafyllou, A.; Rogers, S.N.; Lowe, D.; et al. The clinical determinants of malignant transformation in oral epithelial dysplasia. Oral Oncol. 2012, 48, 969–976, doi:10.1016/j.oraloncology.2012.04.002.
Field, E.A.; McCarthy, C.E.; Ho, M.W.; Rajlawat, B.P.; Holt, D.; Rogers, S.N.; Triantafyllou, A.; Field, J.K.; Shaw, R.J. The management of oral epithelial dysplasia: The Liverpool algorithm. Oral Oncol. 2015, 51, 883–887.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncol. 2009.
Diz P, Gorsky M, Johnson NW, Kragelund C, Manfredi M, Odell E, et al. Oral leukoplakia and erythroplakia: a protocol for diagnosis and management. EAOM – Diagnostic Ther. Protoc. 2011, 1, 1-8.
Van der Waal, I.; Axéll, T. Oral leukoplakia: A proposal for uniform reporting. Oral Oncol. 2002, 38, 521–526.
Reddi, S.P.; Shafer, A.T. Oral Premalignant Lesions: Management Considerations. Oral Maxillofac. Surg. Clin. North Am. 2006, 18, 425–433.
Pereira, J.D.S.; Carvalho, M.D.V.; Henriques, Á.C.G.; De Queiroz Camara, T.H.; Miguel, M.C.D.C.; Freitas, R.D.A. Epidemiology and correlation of the clinicopathological features in oral epithelial dysplasia: Analysis of 173 cases. Ann. Diagn. Pathol. 2011, 15, 98–102, doi:10.1016/j.anndiagpath.2010.08.008.
Rock, L.D.; Rosin, M.P.; Zhang, L.; Chan, B.; Shariati, B.; Laronde, D.M. Characterization of epithelial oral dysplasia in non-smokers: First steps towards precision medicine. Oral Oncol. 2018, 78, 119–125, doi:10.1016/j.oraloncology.2018.01.028.
Dilhari, A.; Weerasekera, M.M.; Siriwardhana, A.; Maheshika, O.; Gunasekara, C.; Karunathilaka, S.; Nagahawatte, A.; Fernando, N. Candida infection in oral leukoplakia: an unperceived public health problem. Acta Odontol. Scand. 2016, 74, 565–569, doi:10.1080/00016357.2016.1220018.
Speight, P.M. Update on oral epithelial dysplasia and progression to cancer. Head Neck Pathol. 2007, 1, 61–66, doi:10.1007/s12105-007-0014-5.
Warnakulasuriya, S.; Kovacevic, T.; Madden, P.; Coupland, V.H.; Sperandio, M.; Odell, E.; Møller, H. Factors predicting malignant transformation in oral potentially malignant disorders among patients accrued over a 10-year period in South East England. J. Oral Pathol. Med. 2011, 40, 677–683, doi:10.1111/j.1600-0714.2011.01054.x.
Arduino, P.G.; Surace, A.; Carbone, M.; Elia, A.; Massolini, G.; Gandolfo, S.; Broccoletti, R. Outcome of oral dysplasia: A retrospective hospital-based study of 207 patients with a long follow-up. J. Oral Pathol. Med. 2009, 38, 540–544, doi:10.1111/j.1600-0714.2009.00782.x.
Watabe, Y.; Nomura, T.; Onda, T.; Yakushiji, T.; Yamamoto, N.; Ohata, H.; Takano, N.; Shibahara, T. Malignant transformation of oral leukoplakia with a focus on low-grade dysplasia. J. Oral Maxillofac. Surgery, Med. Pathol. 2016, 28, 26–29, doi:10.1016/j.ajoms.2015.02.007.
Kujan, O.; Oliver, R.J.; Khattab, A.; Roberts, S.A.; Thakker, N.; Sloan, P. Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol. 2006, doi:10.1016/j.oraloncology.2005.12.014.
El-Naggar A.K., Chan J.K.C., Grandis J.R., Takata T., S.P.J. WHO classification of Head and Neck tumors; 4th ed.; IARC Press: Lyon, 2017; ISBN 9789283224372.
Thomson, P. Oral Precancer; Thomson, P., Ed.; John Wiley & Sons, Ltd.: West Sussex, UK, 2012; ISBN 9781118702840.
Warnakulasuriya, S.; Reibel, J.; Bouquot, J.; Dabelsteen, E. Oral epithelial dysplasia classification systems: Predictive value, utility, weaknesses and scope for improvement. J. Oral Pathol. Med. 2008, 37, 127–133.
Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chen, Y.J.; Chiang, C.P.; Liu, B.Y.; Jeng, J.H.; Chang, H.H.; Kuo, Y.S.; Lan, W.H.; et al. Carcinoma and dysplasia in oral leukoplakias in Taiwan: Prevalence and risk factors. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2006, 101, 472–480, doi:10.1016/j.tripleo.2005.07.024.
Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
Reibel, J.; Gale, N.; Hille, J.; Hunt, J.; Lingen, M.; Muller, S.; Sloan, P.; Tilakaratne, W.; Westra, W.; Williams, M.; et al. Oral potentially malignant disorders and oral epithelial dysplasia. In WHO classification of head and neck tumours; IARC, Ed.; Lyon France, 2017; pp. 112–115 ISBN 9789283224389.
Ranganathan, K.; Kavitha, L. Oral epithelial dysplasia: Classifications and clinical relevance in risk assessment of oral potentially malignant disorders. J. Oral Maxillofac. Pathol. 2019, 23, 19–27.
Barnes, L.; Eveson, J.W.; Reichart, P.; Sidransky, D. World Health Organization Classification of Tumours. Pathology & Genetics. Head and Neck Tumours. International Agency for Research on Cancer (IARC). WHO Classif. Tumours (3rd Ed. 2005, 177–80.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
Meleti, M.; Giovannacci, I.; Vescovi, P.; Pedrazzi, G.; Govoni, P.; Magnoni, C. Histopathological determinants of autofluorescence patterns in oral carcinoma. Oral Dis. 2020, doi:10.1111/odi.13304.
Tiwari, L.; Kujan, O.; Farah, C.S. Optical fluorescence imaging in oral cancer and potentially malignant disorders: A systematic review. Oral Dis. 2020.
Warnakulasuriya, S. White, red, and mixed lesions of oral mucosa: A clinicopathologic approach to diagnosis. Periodontol. 2000 2019, 80, 89–104.
Auluck, A.; Pai, K.M. (Mis)interpretations of leukoplakia. J. Can. Dent. Assoc. (Tor). 2005.
Müller, S. Frictional Keratosis, Contact Keratosis and Smokeless Tobacco Keratosis: Features of Reactive White Lesions of the Oral Mucosa. Head Neck Pathol. 2019, 13, 16–24.
Kramer, I.R.; El, L.; Lee, K.W. The clinical features and risk of malignant transformation in sublingual keratosis. Br. Dent. J. 1978, 144, 171–180, doi:10.1038/sj.bdj.4804055.
Eversole, L.R.; Eversole, G.M.; Kopcik, J. Sanguinaria-associated oral leukoplakia: Comparison with other benign and dysplastic leukoplakic lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2000, 89, 455–464, doi:10.1016/S1079-2104(00)70125-9.
Gupta, P.C.; Mehta, F.S.; Daftary, D.K. Incidence rates of oral cancer and natural history of oral precancerous lesions in a 10-year follow-up study of Indian villagers. Community Dent. Oral Epidemiol. 1980, 8, 287–333, doi:10.1111/j.1600-0528.1980.tb01302.x.
Sreenivasa Bharath, T.; Govind Raj Kumar, N.; Nagaraja, A.; Saraswathi, T.R.; Suresh Babu, G.; Ramanjaneya Raju, P. Palatal changes of reverse smokers in a rural coastal Andhra population with review of literature. J. Oral Maxillofac. Pathol. 2015, 19, 182–187, doi:10.4103/0973-029X.164530.
Woo, S. Bin; Grammer, R.L.; Lerman, M.A. Keratosis of unknown significance and leukoplakia: A preliminary study. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2014, 118, 713–724, doi:10.1016/j.oooo.2014.09.016.
Villa, A.; Hanna, G.J.; Kacew, A.; Frustino, J.; Hammerman, P.S.; Woo, S. Bin Oral keratosis of unknown significance shares genomic overlap with oral dysplasia. Oral Dis. 2019, 25, 1707–1714, doi:10.1111/odi.13155.
Lodi, G.; Porter, S. Management of potentially malignant disorders: Evidence and critique. J. Oral Pathol. Med. 2008, 37, 63–69.
Kanatas, A.N.; Fisher, S.E.; Lowe, D.; Ong, T.K.; Mitchell, D.A.; Rogers, S.N. The configuration of clinics and the use of biopsy and photography in oral premalignancy: A survey of consultants of the British Association of Oral and Maxillofacial Surgeons. Br. J. Oral Maxillofac. Surg. 2011, 49, 99–105, doi:10.1016/j.bjoms.2010.01.016.
Kumar, A.; Cascarini, L.; McCaul, J.A.; Kerawala, C.J.; Coombes, D.; Godden, D.; Brennan, P.A. How should we manage oral leukoplakia? Br. J. Oral Maxillofac. Surg. 2013, 51, 377–383, doi:10.1016/j.bjoms.2012.10.018.
Dionne, K.R.; Warnakulasuriya, S.; Zain, R.B.; Cheong, S.C. Potentially malignant disorders of the oral cavity: Current practice and future directions in the clinic and laboratory. Int. J. Cancer 2015, 136, 503–515.
Diajil, A.; Robinson, C.M.; Sloan, P.; Thomson, P.J. Clinical Outcome Following Oral Potentially Malignant Disorder Treatment: A 100 Patient Cohort Study. Int. J. Dent. 2013, 2013, 1–8, doi:10.1155/2013/809248.
Ribeiro, A.S.; Salles, P.R.; da Silva, T.A.; Mesquita, R.A. A Review of the Nonsurgical Treatment of Oral Leukoplakia. Int. J. Dent. 2010, 2010, 1–10, doi:10.1155/2010/186018.
Jaiswal, G.; Jaiswal, S.; Kumar, R.; Sharma, A. Field cancerization: concept and clinical implications in head and neck squamous cell carcinoma. J. Exp. Ther. Oncol. 2013.
Arduino, P.G.; Lodi, G.; Cabras, M.; Macciotta, A.; Gambino, A.; Conrotto, D.; Karimi, D.; El Haddad, G.; Carbone, M.; Broccoletti, R. A Randomized Controlled Trial on Efficacy of Surgical Excision of non-dysplastic Leukoplakia to Prevent Oral Cancer. Cancer Prev. Res. 2020, canprevres.0234.2020, doi:10.1158/1940-6207.capr-20-0234.
Mehanna, H.M.; Rattay, T.; Smith, J.; McConkey, C.C. Treatment and follow-up of oral dysplasia – A systematic review and meta-analysis. Head Neck 2009, doi:10.1002/hed.21131.
Saito, T.; Sugiura, C.; Hirai, A.; Notani, K.I.; Totsuka, Y.; Shindoh, M.; Fukuda, H. Development of squamous cell carcinoma from pre-existent oral leukoplakia: With respect to treatment modality. Int. J. Oral Maxillofac. Surg. 2001, 30, 49–53.
Zhang, L.; Lubpairee, T.; Laronde, D.M.; Rosin, M.P. Should severe epithelial dysplasia be treated? Oral Oncol. 2016, 60, 125–129, doi:10.1016/j.oraloncology.2016.07.007.
Balasundaram, I.; Payne, K.F.B.; Al-Hadad, I.; Alibhai, M.; Thomas, S.; Bhandari, R. Is there any benefit in surgery for potentially malignant disorders of the oral cavity? J. Oral Pathol. Med. 2014.
Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.
Kuribayashi, Y.; Tsushima, F.; Morita, K.; Matsumoto, K.; Sakurai, J.; Uesugi, A.; Sato, K.; Oda, S.; Sakamoto, K.; Harada, H. Long-term outcome of non-surgical treatment in patients with oral leukoplakia. Oral Oncol. 2015, 51, 1020–1025, doi:10.1016/j.oraloncology.2015.09.004.
Mogedas-Vegara, A.; Hueto-Madrid, J.A.; Chimenos-Küstner, E.; Bescós-Atín, C. Oral leukoplakia treatment with the carbon dioxide laser: A systematic review of the literature. J. Cranio-Maxillofacial Surg. 2016, doi:10.1016/j.jcms.2016.01.026.







