La fibrosi sottomucosa orale (OSMF) è una condizione cicatriziale cronica e progressiva che colpisce la mucosa orofaringea e spesso l’esofago superiore.
Non esiste una definizione universalmente accettata di OSMF e le definizioni più recenti mirano a fornire informazioni sull’eziologia, l’epidemiologia e le caratteristiche cliniche della malattia. Pindborg nel 1966 ha definito l’OSMF come “una malattia insidiosa e cronica che colpisce qualsiasi parte della cavità orale e talvolta la faringe”. Brad (2019) ha definito l’OSMF come una “condizione cronica, precancerosa e spesso debilitante caratterizzata da una fibrosi lentamente progressiva della cavità orale e dell’orofaringe” e Langdon (2007) ha descritto l’OSMF come “una malattia progressiva in cui si formano bande fibrose sotto la mucosa orale”.
Eziopatogenesi
L’eziologia di OSFM è multifattoriale
- Areca o noce di betel è il nome della noce derivante dalla pianta di Areca.
- Nello sviluppo dell’OSMF è stata notata una relazione dose-dipendente sia per la frequenza che per la durata della masticazione delle noci di betel.
- La masticazione di areca, betel o paan è un’abitudine ricreativa comune nel subcontinente indiano e il suo consumo sta diventando sempre più comune nelle comunità occidentali a causa del flusso migratorio verso ovest.
- Alcune preparazioni a base di noce di Areca includono tabacco e altri noti agenti cancerogeni. La noce di Areca in sé è un cancerogeno riconosciuto, in quanto contiene alcuni tannini e alcaloidi che hanno citotossicità e genotossicità. L’idrossido di calcio, un altro ingrediente comune nelle preparazioni a base di noce di Areca, presenta elevate concentrazioni di arsenico.
- Nella religione induista, la noce di Areca è ritenuta divina e viene consumata per il suo valore medicinale. È anche considerata un afrodisiaco, un agente che migliora l’igiene orale e riduce l’alitosi, uno stimolante salivare che migliora la digestione e, nel subcontinente indiano, si ritiene che abbia un effetto stabilizzante sul controllo glicemico nei pazienti con diabete.
- L’arecolina, un sottoprodotto del metabolismo della noce di Areca, è un alcaloide che attraversa facilmente la barriera emato-encefalica ed è implicato nella dipendenza all’abitudine di masticare la noce di Areca. Gli effetti fisiologici che ne derivano sono spesso descritti come euforici; gli utilizzatori riportano anche una maggiore percezione e una migliore produttività.
- L’abitudine di masticare le noci di Areca è stata implicata come fattore eziologico nello sviluppo dell’OSMF. L’Agenzia Internazionale per la Ricerca sul Cancro ha classificato la noce di Areca come un agente cancerogeno di Gruppo 1.
- Altri fattori eziologici segnalati includono un’abitudine preesistente all’uso di tabacco (senza fumo), carenze ematiche, anemia e malnutrizione.
- Può anche esistere una predisposizione genetica, con associazione ad alcuni sottotipi e aplotipi HLA (A10/DR3).
- La malnutrizione, l’anemia e le carenze ematiche sono associate all’atrofia della mucosa orale e al potenziale aumento di sintesi del collagene.
L’abitudine di masticare le noci di Areca è il principale fattore di rischio eziologico nello sviluppo dell’OSMF, mentre i fattori sopra citati possono essere considerati come contributivi.
Istopatologia
- L’OSMF è caratterizzato da un deposito anomalo di collagene.
- Gli alcaloidi dell’areca, come l’arecolina, provocano la proliferazione dei fibroblasti. Anche gli aromi presenti nelle preparazioni a base di noce di areca, come i tannini, possono inibire l’attività della collagenasi.
- La progressione della malattia è associata alla sostituzione del collagene di tipo 1, facilmente degradabile, con il collagene di tipo 3, più resistente. Si verifica anche un’inibizione della fagocitosi del collagene.
- I campioni istopatologici presentano alcune caratteristiche dell’OSMF, come l’atrofia o l’assottigliamento dell’epitelio, l’ialinizzazione iuxta-epiteliale e il collagene con una densità variabile insieme a una lamina propria fibrosa e a fibrille di ancoraggio.
Epidemiologia
L’OSMF è diffuso prevalentemente nel subcontinente indiano e nel Sud-Est asiatico, tra cui India, Taiwan, Cina, Bangladesh, Malesia, Singapore, Thailandia e Sri Lanka.È stata segnalata anche in Sudafrica e in Arabia Saudita.L’OSMF è presente nelle popolazioni asiatiche degli Stati Uniti, del Regno Unito e dei paesi sviluppati e pertanto la patologia ha un peso sanitario globale. Il numero di casi globali nel 1996 è stato stimato a 2,5 milioni. La prevalenza in India è stata riportata fino al 30%. Il consumo di noce Areca a livello globale è stato segnalato intorno al 5-20%. I sintomi di OSMF tendono a svilupparsi nel quarto -quinto decennio di vita, ma sono stati segnalati undici casi anche in pazienti giovani. La malattia ha una preponderanza femminile per ragioni sconosciute.
Presentazione clinica
- OSMF è stato clinicamente classificato da More (2012) in quattro fasi, che comprendono una fase eruttiva e una fibrotica.
- La fase eruttiva può essere associata alla formazione di vescicole e sensazione di bruciore e disagio diffuso nella cavità orale. La consistenza della mucosa orale inizia a cambiare, perdendo la sua elasticità. Il pallore della mucosa progredisce fino a quando la mucosa inizia a sbiancarsi. Possono svilupparsi petecchie della mucosa, così come una pigmentazione melanotica della mucosa, l’ulcerazione della mucosa o presenza di aree eritematose.
- Nella seconda fase, la fibrosi si verifica nelle vescicole e nelle ulcere durante la fase di guarigione. Si sviluppano delle bande fibrose palpabili, verticali e circolari nella mucosa buccale e/o nell’orofaringe con o senza stomatite. Bande più sottili possono essere presenti nelle fasi precedenti.
- Nella terza fase, le bande fibrose palpabili possono essere presenti in qualsiasi parte della cavità orale con o senza stomatite. Il quarto stadio comprende tutto ciò appena descritto con lo sviluppo di un disturbo potenzialmente maligno o di un franco carcinoma squamocellulare orale.
- Nelle fasi da due a quattro, sono inclusi effetti specifici come trisma, depigmentazione della gengiva, ugola atrofica e depapillazione della lingua. Si possono osservare anche cambiamenti nell’estetica facciale come l’affondamento delle guance non correlato all’età o allo stato nutrizionale.
- Nei casi più gravi, possono svilupparsi deficit del linguaggio e dell’udito. OSMF ha un impatto significativo sulla qualità della vita nelle fasi successive.
- More ha anche descritto una stadiazione funzionale di OSMF basata sull’apertura bocca interincisale; fase 1 (maggiore o uguale a 35 mm), fase 2 (tra 25 e 35 mm), fase 3 (tra 15 e 25mm) e fase 4 (inferiore a 15 mm).
- Nel 1956, Paymaster è stato il primo a segnalare il potenziale premaligno della fibrosi sottomucosa orale.
- Ci sono variazioni geografiche significative nei tassi di trasformazione maligni segnalati. Il tasso è generalmente più alto in India, rispetto ad altri paesi.
- Una possibile spiegazione di questo è il modo in cui la noce Areca viene preparata con additivi aggiuntivi. Studi taiwanesi hanno scoperto che i prodotti del tabacco non sono generalmente utilizzati in combinazione a prodotti a base di noci Areca e questo potrebbe spiegare il basso tasso di trasformazione maligna in questa popolazione.
- Il tasso di trasformazione maligna è stato stimato tra l’1 e il 9%.
- Un tasso di trasformazione maligna più alto è stato osservato nei soggetti con una leucoplachia orale concomitante.
- I carcinomi che generano dall’evoluzione maligna di una OSMF sono stati riferiti per essere sia meno che più aggressivi rispetto ai carcinomi formati da altre lesioni all’interno della cavità orale.
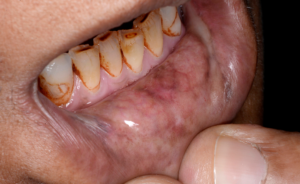
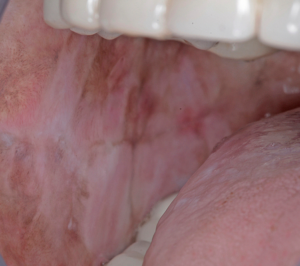
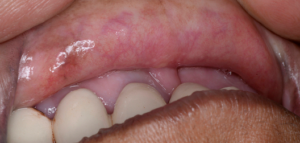
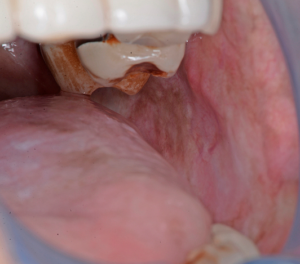
Diagnosi differenziale
Nelle fasi iniziali, OSMF può essere diagnosticato in modo errato. I pazienti che lamentano una sensazione di bruciore orale con atrofia delle mucose possono riceve diagnosi di disestesia orale, con o senza un fattore contributivo come una carenza ematinica (vitamina B12, folati) o l’anemia.
La sclerodermia è una condizione autoimmune che colpisce la pelle, gli organi interni e i vasi sanguigni. È caratterizzato da sclerosi diffusa della pelle e di altri tessuti connettivi. La sclerodermia può presentarsi con bande fibrose nella mucosa orale e trisma progressivo. I pazienti con sclerodermia avranno anche disturbi extraorali. L’imaging microvascolare e il test per la ricerca degli autoanticorpi contribuiscono a stabilire la diagnosi di sclerodermia.
L’amiloidosi è caratterizzata dalla deposizione nei tessuti delle proteine dell’amiloide (proteina fibrillare). L’amiloidosi sistemica può presentarsi con macroglossia o trisma progressivo. Un’attenta anamnesi, gli esami ematologici e una biopsia possono aiutare nel stabilire la diagnosi corretta.
Nelle sue fasi successive, OSMF può presentarsi come SCC orale franco, leucoplachia o eritroplachia.
Diagnosi
- Un’attenta indagine sulle abitudini ricreative suggerirà fortemente una diagnosi di OSMF. Le biopsie incisionali sono necessarie poiché OSMF è una condizione potenzialmente maligna.
- L’analisi istopatologica è utile nella stadiazione clinica della malattia, in cui la distribuzione e il numero di fibroblasti, fibre di collagene, la presenza e il numero di cellule infiammatorie e vasi sanguigni sono correlati con la stadiazione della malattia.
- Se durante la biopsia si verificano dei traumi, questi inducono un grado di fibrosi che può contribuire a peggiorare il trisma.
- Determinati biomarcatori, quale ad esempio l’mRNA, possono influenzare la stadiazione della malattia e l’analisi genetica degli esemplari e possono predire la trasformazione maligna futura.
- Ematossilina ed eosina è la colorazione più comunemente utilizzata nella diagnosi di OSMF.
Gestione
I pazienti dovrebbero essere informati in merito all’ abitudine di masticare la noce di Areca, sul suo ruolo nell’eziopatogenesi della fibrosi orale sottomucosa e nel rischio di trasformazione maligna di tale disordine; inoltre, dovrebbero essere incoraggiati ad arrestare tale abitudine. OSMF rappresenta un fardello significativo nelle malattie globali e la prevenzione primaria è un obiettivo chiave nella strategia governativa dei paesi nel subcontinente indiano. Approcci come il divieto dei prodotti vegetali di Areca e dei loro preparati, nonché l’educazione sugli effetti nocivi della masticazione della noce di Areca hanno dimostrato di essere utili nella prevenzione primaria sia a livello individuale che di popolazione. OSMF presenta spesso ritardi diagnostici creando un dilemma gestazionale.
» Gestione conservativa
Gestione conservativa
- Negli stadi da moderati a gravi di OSMF, il grado di fibrosi è irreversibile e il trattamento è principalmente sintomatico.
- La fisioterapia rappresenta l’approccio conservativo più comune per la gestione della progressiva riduzione dell’apertura della bocca. Si consigliano vari esercizi volti ad allungare i tessuti e rafforzare i muscoli della masticazione. Possono essere utili anche dei dispositivi su misura per la riduzione del trisma. I pazienti vengono incoraggiati a massaggiare i muscoli di masticazione. L’igiene orale dovrebbe essere rinforzata poiché i pazienti con OSMF presentano un’elevata frequenza di malattie dentali (malattia parodontale, carie dentaria e alitosi).
- Possono essere prescritti anestetici locali ai pazienti che si lamentano di disagio orale generalizzato. Nelle fasi più avanzate di OSMF, le iniezioni intra-lesionali di corticosteroidi sono state utili nella riduzione del trisma.
» View less
» Gestione chirurgica
Gestione chirurgica
- Il trattamento chirurgico può essere indicato in casi gravi di trisma e mira a migliorare l’apertura della bocca, la masticazione e la salute orale.
- L’approccio chirurgico comporta la rimozione del tessuto fibroso e, a seguito dell’intervento, è volto a mantenere l’apertura della bocca dopo la rimozione e il rilascio muscolare.
- L’escissione semplice delle bande fibrose esacerba la fibrosi orale sottomucosa, anche se il trauma iatrogeno del trattamento chirurgico comporta una fibrosi conseguente.
- Il trisma cronico, come risultato della OSMF, può portare a cambiamenti fisiologici nel tendine temporale. L’impiego di innesti cutanei possono aiutare a risolvere questo problema; come ad esempio l’utilizzo di un innesto cutaneo a spessore parziale dopo miotomia temporale bilaterale o una coronoidectomia. Queste sono procedure chirurgiche invasive che non dovrebbero essere intraprese con leggerezza, ma possono alleviare i sintomi del trisma.
- Può essere considerata anche la miotomia di altri muscoli masticatori.
» View less
Sommario
L’OSMF è una condizione cronica e progressiva che si traduce in fibrosi della mucosa orofaringea e, occasionalmente, dell’esofago superiore, a seguito di cambiamenti fisiologici indotti dalla masticazione della noce di Areca. La noce Areca e i suoi metaboliti sono cancerogeni e vari preparati a base di noce Areca includono altri agenti cancerogeni. Il tasso di trasformazione maligna varia geograficamente ed è stato calcato tra 1% e il 9%. Il tasso di trasformazione maligna è dose-dipendente e correlato con la durata e l’intensità dell’abitudine alla masticazione della noce di Areca e se usato in combinazione con il consumo di alcol e tabacco. Non esiste un protocollo di gestione universalmente accettato.
A livello globale, la conoscenza della condizione tra la popolazione generale e gli operatori sanitari è bassa. Questo può contribuire alla presentazione tardiva di questi pazienti. Tutti gli operatori sanitari hanno un ruolo nella prevenzione primaria e nel riconoscimento della malattia.
Referenze e ulteriori letture
J.D. Langdon, in Oral and Maxillofacial Surgery (Second Edition), 2007
Brad W. Neville DDS, … Angela C. Chi DMD, in Color Atlas of Oral and Maxillofacial Diseases, 2019
Raman Bedi, Crispian Scully, in Manson’s Tropical Infectious Diseases (Twenty-third Edition), 2014
More C, Gupta S, Joshi J, Varma S. Classification system of Oral submucous fibrosis. J Indian Acad Oral Med Radiol. 2012;24(1):24–9
Ali, F. M., Patil, A., Patil, K. and Prasant, M. C. (2014) ‘Oral submucous fibrosis and its dermatological relation’, Indian Dermatol Online J, 5(3), pp. 260-5.
Angadi, P. V. and Rao, S. S. (2011) ‘Areca nut in pathogenesis of oral submucous fibrosis: revisited’, Oral Maxillofac Surg, 15(1), pp. 1-9.
Arakeri, G., Patil, S. G., Aljabab, A. S., Lin, K. C., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017a) ‘Oral submucous fibrosis: An update on pathophysiology of malignant transformation’, J Oral Pathol Med, 46(6), pp. 413-417.
Arakeri, G., Rai, K. K., Boraks, G., Patil, S. G., Aljabab, A. S., Merkx, M. A. W., Carrozzo, M. and Brennan, P. A. (2017b) ‘Current protocols in the management of oral submucous fibrosis: An update’, J Oral Pathol Med, 46(6), pp. 418-423.
Arakeri, G., Rai, K. K., Hunasgi, S., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017c) ‘Oral submucous fibrosis: An update on current theories of pathogenesis’, J Oral Pathol Med, 46(6), pp. 406-412.
Cox, S. C. and Walker, D. M. (1996) ‘Oral submucous fibrosis. A review’, Aust Dent J, 41(5), pp. 294-9.
Garg, A., Chaturvedi, P. and Gupta, P. C. (2014) ‘A review of the systemic adverse effects of areca nut or betel nut’, Indian J Med Paediatr Oncol, 35(1), pp. 3-9.
Gupta, P. C. and Warnakulasuriya, S. (2002) ‘Global epidemiology of areca nut usage’, Addict Biol, 7(1), pp. 77-83.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Murti, P. R., Bhonsle, R. B., Pindborg, J. J., Daftary, D. K., Gupta, P. C. and Mehta, F. S. (1985) ‘Malignant transformation rate in oral submucous fibrosis over a 17-year period’, Community Dent Oral Epidemiol, 13(6), pp. 340-1.
Pandya, S., Chaudhary, A. K., Singh, M. and Mehrotra, R. (2009) ‘Correlation of histopathological diagnosis with habits and clinical findings in oral submucous fibrosis’, Head Neck Oncol, 1, pp. 10.
Passi, D., Bhanot, P., Kacker, D., Chahal, D., Atri, M. and Panwar, Y. (2017) ‘Oral submucous fibrosis: Newer proposed classification with critical updates in pathogenesis and management strategies’, Natl J Maxillofac Surg, 8(2), pp. 89-94.
PAYMASTER, J. C. (1956) ‘Cancer of the buccal mucosa; a clinical study of 650 cases in Indian patients’, Cancer, 9(3), pp. 431-5.
Pindborg, J. J. and Sirsat, S. M. (1966) ‘Oral submucous fibrosis’, Oral Surg Oral Med Oral Pathol, 22(6), pp. 764-79.
Rai, A., Ahmad, T., Parveen, S., Faizan, M. I. and Ali, S. (2020) ‘Expression of transforming growth factor beta in oral submucous fibrosis’, J Oral Biol Craniofac Res, 10(2), pp. 166-170.
Rai, S., Rattan, V., Gupta, A. and Kumar, P. (2018) ‘Conservative management of Oral Submucous Fibrosis in early and intermediate stage’, J Oral Biol Craniofac Res, 8(2), pp. 86-88.
Rajendran, R. (1994) ‘Oral submucous fibrosis: etiology, pathogenesis, and future research’, Bull World Health Organ, 72(6), pp. 985-96.
Rao, N. R., Villa, A., More, C. B., Jayasinghe, R. D., Kerr, A. R. and Johnson, N. W. (2020) ‘Oral submucous fibrosis: a contemporary narrative review with a proposed inter-professional approach for an early diagnosis and clinical management’, J Otolaryngol Head Neck Surg, 49(1), pp. 3.
Shih, Y. H., Wang, T. H., Shieh, T. M. and Tseng, Y. H. (2019) ‘Oral Submucous Fibrosis: A Review on Etiopathogenesis, Diagnosis, and Therapy’, Int J Mol Sci, 20(12).
Silva, W. P., Wastner, B. F., Bohn, J. C., Jung, J. E., Schussel, J. L. and Sassi, L. M. (2015) ‘Unusual presentation of oral amyloidosis’, Contemp Clin Dent, 6(Suppl 1), pp. S282-4.
Yoithapprabhunath, T. R., Maheswaran, T., Dineshshankar, J., Anusushanth, A., Sindhuja, P. and Sitra, G. (2013) ‘Pathogenesis and therapeutic intervention of oral submucous fibrosis’, J Pharm Bioallied Sci, 5(Suppl 1), pp. S85-8.







