Definición
La LVP se puede considerar como una forma distinta de leucoplasia oral (LO), caracterizada por lesiones multifocales, curso clínico progresivo y cambios en la apariencia clínica y características histopatológicas. Sin embargo, tal posición para clasificar la LVP como una entidad separada no está universalmente aceptada, ya que las leucoplasias grandes y generalizadas, y no solo las LVP, conllevan un riesgo distinto de transformación maligna.
En 2020, el Centro Colaborador de la Organización Mundial de la Salud (OMS) para el estudio del Cáncer Oral reconoció que “a pesar de la imperfección del término LVP para abarcar un grupo más amplio de pacientes con enfermedad multifocal, el término se utiliza ampliamente, y el Grupo de Trabajo recomendó conservar este término”. El mismo grupo propuso la siguiente definición: “un trastorno progresivo, persistente e irreversible caracterizado por la presencia de múltiples leucoplasias que frecuentemente se convierten en verrugosas”.
Epidemiología y Riesgo de Cáncer
- Se estima que la prevalencia global de la Leucoplasia Oral oscila entre el 1,5% y el 2,6%. La LVP es menos común que la leucoplasia estándar y no se dispone de datos sobre su prevalencia.
- La etiología de la LVP sigue siendo desconocida.
- La LVP es más frecuente en mujeres de edad avanzada, sin predilección racial, y no está asociada con los factores de riesgo tradicionales para la Leucoplasia Oral y el carcinoma oral de células escamosas (COCE), es decir, consumo de tabaco y alcohol.
- Aproximadamente dos tercios de los casos de LVP son en pacientes que nunca han fumado y que no refieren abuso de alcohol.
- La prevalencia del virus del papiloma humano (VPH) notificada en la LVP oscila entre el 0 y el 88 % según los resultados de estudios con un número reducido de pacientes.
- Un estudio que investigó la prevalencia del VPH en 58 pacientes no mostró diferencias significativas entre los pacientes afectados por LVP y aquellos con Leucoplasia Oral convencional (24% versus 25%).
- En el primer examen histopatológico, la mayoría de las lesiones de LVP (52,5%) muestran hiperqueratosis sin displasia o hiperplasia verrugosa.
- Sin embargo, la LVP se asocia con la mayor incidencia de cáncer oral entre los Trastornos Orales Potencialmente Malignos (TOPM), ya sea carcinoma verrugoso o carcinoma de células escamosas.
- Aproximadamente el 61 % de los pacientes con LVP desarrollan carcinoma oral durante un período promedio de 7,4 años, aunque una revisión sistemática estimó que la transformación maligna ocurre en el 49,5 % (IC 26,7 %-72,4 %) de los casos de LVP (Spriano et al., 2020) .
- La incidencia anual se estima en 10% por año.
- Series de casos recientes, en pacientes afectados por LVP, evidencian la aparición de múltiples carcinomas primarios localizados en los rebordes alveolares.
- La LVP se asocia con una mortalidad general del 40%.
Presentación clínica
Clínicamente, la LVP puede afectar extensamente una única localización de la mucosa oral, pero con mayor frecuencia es multifocal y afecta la encía, la mucosa yugal y la lengua en sitios contiguos y no contiguos de la cavidad oral. Las localizaciones orales más frecuentemente afectadas son la encía (62,7%), la mucosa yugal (59,8%) y la lengua (49,1%). Las Figuras 1-4 ilustran la la LVP que afecta múltiples localizaciones de la cavidad bucal.
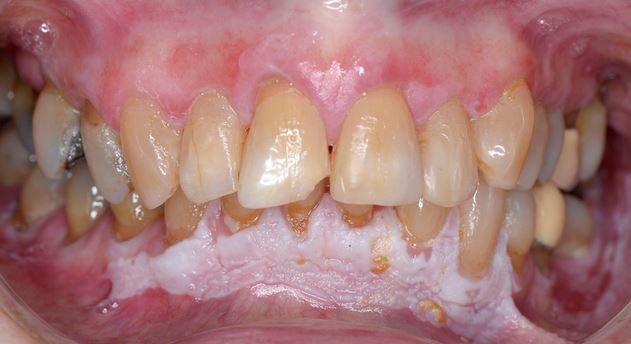
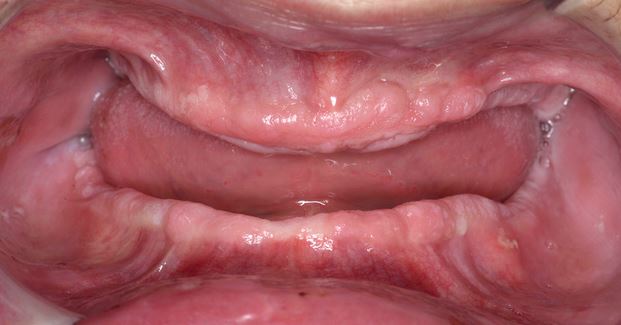
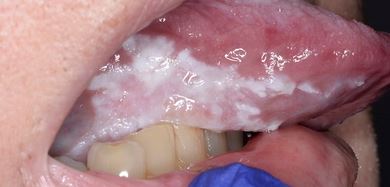
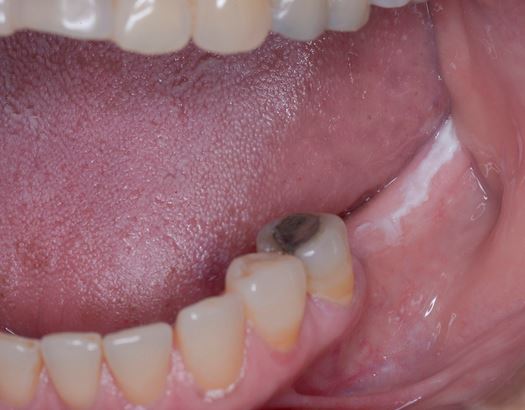
La multifocalidad y el curso clínico progresivo son las principales características de la LVP. Las lesiones orales en la LVP con frecuencia se asocian con cambios continuos en el cuadro clínico e histopatológico. La Tabla 1 describe las características clínicas típicas de la LVP como se describe en el documento de consenso reciente sobre TOPM publicado por el Centro Colaborador de la Organización Mundial de la Salud (OMS) para el estudio del Cáncer Oral .
| Presentación Clínica |
| Múltiples manchas blancas gruesas en más de dos localizaciones orales, que se encuentran con frecuencia en la encía, los rebordes alveolares, y el paladar. |
| La mayoría de las lesiones presentan un patrón verrugoso |
| Las lesiones se diseminan y se unen durante su progresión. |
| Recidiva en un área previamente tratada |
Tabla 1: Presentación Clínica de LVP según el Centro Colaborador de la Organización Mundial de la Salud (OMS) para el estudio del Cáncer Oral, 2020 (4)
La LVP generalmente comienza como una leucoplasia homogénea sin displasia en el examen histológico y evoluciona progresivamente a lesiones verrugosas en áreas únicas o múltiples de la mucosa oral. Al principio, la LVP se manifiesta como una o más leucoplasias que afectan progresivamente a múltiples localizaciones con diseminación gradual de una sola lesión o coalescencia de múltiples lesiones [3,4]. En las etapas iniciales, la LVP puede presentarse como una lesión multifocal que carece de la típica apariencia verrugosa. Además, la lesión inicial puede ser blanca y plana, mostrando a veces una apariencia liquenoide, lo que dificulta el diagnóstico diferencial con el liquen plano oral (LPO) [3,4,28,29]. En tales casos, la PVL puede ser erróneamente tratada como un LPO durante largos períodos con el riesgo subsiguiente de pasar por alto o retrasar el diagnóstico de un COCE.
La LVP también se ha caracterizado por un eritema prominente (19% de los casos en la serie de Villa et al. 2018) con una tasa de transformación maligna del 100% en comparación con aquellas lesiones de LVP sin componente eritematoso (62,5%).
Diagnóstico
- Las características histopatológicas de la LVP no son patognomónicas y son inespecíficas, y van desde la hiperqueratosis en etapas tempranas hasta la hiperplasia verrugosa y diferentes grados de displasia.
- Además, los casos de LVP caracterizados clínicamente por un componente inflamatorio o apariencia liquenoide pueden mostrar una banda linfocítica «liquenoide» y ser mal diagnosticados como LPO.
- Por esta razón, el diagnóstico definitivo de LVP se realiza basándose en una combinación de hallazgos clínicos e histopatológicos.
- Toda lesión blanca, que se vuelve verrugosa y exofítica, que se extiende con el tiempo y recurre después del tratamiento, debe ser considerada como LVP.
Desde la primera definición en 1985, otros autores han propuesto criterios diagnósticos alternativos. En 2010, Cerero-Lapiedra et al. propusieron cinco criterios mayores y cuatro menores, y combinaciones específicas entre ellos, para establecer un diagnóstico precoz de la LVP (Tabla 2).
| Criterios Mayores | Criterios Menores |
| Leucoplasia oral que afecta a más de dos localizaciones orales diferentes con predominio en encías, procesos alveolares y paladar | Las lesiones cubren una extensión de la mucosa que supera los 3 cm (sumando todas las áreas afectadas) |
| Aspecto clínico verrugoso | Género femenino |
| Las lesiones muestran progresión y diseminación clínica. | No fumadores (sin importar el género) |
| Recidiva en un área previamente tratada | Tiempo de evolución superior a los 5 años |
| Cuadro histopatológico de hiperqueratosis o hiperplasia verrugosa, carcinoma verrugoso o carcinoma de células escamosas. |
El diagnóstico de PVL se puede hacer cuando:
tres criterios mayores (siendo uno el criterio histopatológico)
o dos criterios mayores (siendo uno el criterio histopatológico) y dos criterios menores
Table 2: Criterios diagnósticos según Cerrero-Lapiedra et al. (Modified by [3,20]).
Carrard et al. propusieron simplificar los criterios diagnósticos de la LVP omitiendo la distinción entre criterios mayores y menores, y sugirieron cuatro criterios que deberían cumplirse (Tabla 3).
| Criterios de diagnóstico modificados: se deben cumplir los cuatro criterios. |
| Leucoplasia que muestra la presencia de áreas verrugosas que involucran más de dos sublocalizaciones orales. Se reconocen las siguientes sublocalizaciones orales: dorso de la lengua (unilateral o bilateral), borde de la lengua, mucosa yugal, mucosa alveolar o encía del maxilar superior, mucosa alveolar o encía del maxilar inferior, paladar duro y blando, suelo de la boca, paladar superior, labio superior y labio inferior |
| Sumando todas las localizaciones involucradas, la extensión mínima debe ser de al menos tres centímetros. |
| Un período bien documentado de evolución de la enfermedad de al menos cinco años, que se caracteriza por la propagación y el agrandamiento y la aparición de una o más recidivas en un área previamente tratada. |
| La disponibilidad de al menos una biopsia para descartar la presencia de un carcinoma verrugoso o carcinoma de células escamosas |
Tabla 3: Criterios diagnósticos simplificados.
- A la hora de realizar una biopsia de una lesión con sospecha de LVP, así como de una Leucoplasia Oral no homogénea, es importante elegir las zonas más representativas para evitar el infradiagnóstico.
- El examen histopatológico puede conducir a un diagnóstico variable dentro de la misma lesión. Por esta razón, con frecuencia se recomiendan la realización de múltiples biopsias de mapeo. Las biopsias de mapeo múltiples y periódicas están indicadas en la LVP para detectar diferentes grados de displasia o para excluir el COCE..
- Se ha descrito tanto para la LVP como para la Leucoplasia oral no homogénea, que aproximadamente entre el 10%-17% de los casos de COCE pueden no ser diagnosticados al realizar una única biopsia.
Manejo
- El manejo y tratamiento de la LVP es particularmente desafiante. En la última década se han propuesto diferentes abordajes para reducir la alta incidencia de cáncer oral entre los pacientes afectados por LVP.
- Hasta la fecha, ninguno de los tratamientos (cirugía, ablación con láser, retinoides, terapia fotodinámica y quimioterapia) ha demostrado ser eficaz para reducir el desarrollo del cáncer oral en estos pacientes.
- A pesar de la falta de evidencia sobre la eficacia, el tratamiento quirúrgico es la intervención más frecuentemente adoptada en el manejo de la LVP.
- Cuando la LVP se caracteriza por lesiones de pequeño tamaño, se puede intentar la escisión, pero el paciente debe saber que será necesario un seguimiento continuo debido al alto riesgo de cáncer oral y el riesgo de recurrencia de la lesión (71%).
- La mayoría de los casos de LVP muestran lesiones grandes e involucran áreas multifocales no contiguas.
- Una revisión sistemática reciente concluyó que la tasa general de recidiva de la LVP para todas las modalidades de tratamiento fue de aproximadamente 85 %, sin ninguna reducción en la incidencia de cáncer.
- Por todas estas razones, la extirpación quirúrgica en LVP extensa puede considerarse una opción de tratamiento agresiva, poco práctica e innecesaria.
- Muchos clínicos eligen un enfoque de «esperar y ver», basado en exámenes clínicos regulares y múltiples biopsias periódicas.
- El objetivo de este enfoque es identificar la aparición muy temprana de un carcinoma oral, ofreciendo el mejor resultado de tratamiento y pronóstico.
En conclusión, considerando la alta incidencia de cáncer en pacientes con LVP, es obligatorio realizar un seguimiento clínico estricto (cada 3-6 meses dependiendo de las características clínicas) y múltiples biopsias. El momento de la transformación maligna es impredecible, por lo que es necesario un seguimiento de por vida.
Referencias y lecturas complementarias
1. Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, 60, 285–298, doi:10.1016/0030-4220(85)90313-5.
2. Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9, 122, doi:10.1186/1477-7819-9-122.
3. Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760, doi:10.1111/odi.12830.
4. Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
5. Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
6. van der Waal, I. Oral leukoplakia; a proposal for simplification and consistency of the clinical classification and terminology. Med. Oral Patol. Oral y Cir. Bucal 2019, 24, e799–e803, doi:10.4317/medoral.23372.
7. Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003, 39, 770–780, doi:10.1016/S1368-8375(03)00102-7.
8. Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
9. Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental practitioners. Br. Dent. J. 2017, 223, 655–661, doi:10.1038/sj.bdj.2017.881.
10. Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2021, 27, 919–923, doi:10.1111/odi.13622.
11. Bagan, J. V.; Jimenez, Y.; Murillo, J.; Gavaldá, C.; Poveda, R.; Scully, C.; Alberola, T.M.; Torres-Puente, M.; Pérez-Alonso, M. Lack of Association Between Proliferative Verrucous Leukoplakia and Human Papillomavirus Infection. J. Oral Maxillofac. Surg. 2007, 65, 46–49, doi:10.1016/j.joms.2005.12.066.
12. Palefsky, J.M.; Silverman, S.; Abdel‐Salaam, M.; Daniels, T.E.; Greenspan, J.S. Association between proliferative verrucous leukoplakia and infection with human papillomavirus type 16. J. Oral Pathol. Med. 1995, 24, 193–197, doi:10.1111/j.1600-0714.1995.tb01165.x.
13. Campisi, G.; Giovannelli, L.; Ammatuna, P.; Capra, G.; Colella, G.; Di Liberto, C.; Gandolfo, S.; Pentenero, M.; Carrozzo, M.; Serpico, R.; et al. Proliferative verrucous vs conventional leukoplakia: No significantly increased risk of HPV infection. Oral Oncol. 2004, 40, 835–840, doi:10.1016/j.oraloncology.2004.02.007.
14. Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
15. Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
16. Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
17. Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
18. Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2021, 115, 105121, doi:10.1016/j.oraloncology.2020.105121.
19. Capella, D.L.; Gonçalves, J.M.; Abrantes, A.A.A.; Grando, L.J.; Daniel, F.I. Proliferative verrucous leukoplakia: diagnosis, management and current advances. Braz. J. Otorhinolaryngol. 2017, 83, 585–593, doi:10.1016/j.bjorl.2016.12.005.
20. Cerero-Lapiedra, R.; Balade-Martinez, D.; Moreno-Lopez, L.; Esparza-Gomez, G.; Bagan, J. Proliferative verrucous leukoplakia: A proposal for diagnostic criteria. Med. Oral Patol. Oral y Cir. Bucal 2010, 15, e839–e845, doi:10.4317/medoral.15.e839.
21. Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
22. Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
23. Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
24. Abadie, W.M.; Partington, E.J.; Fowler, C.B.; Schmalbach, C.E. Optimal Management of Proliferative Verrucous Leukoplakia: A Systematic Review of the Literature. Otolaryngol. – Head Neck Surg. (United States) 2015, 153, 504–511, doi:10.1177/0194599815586779.
25. Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
26. Ghazali, N.; Bakri, M.M.; Zain, R.B. Aggressive, multifocal oral verrucous leukoplakia: proliferative verrucous leukoplakia or not? J. Oral Pathol. Med. 2003, 32, 383–392, doi:10.1034/j.1600-0714.2003.00180.x.
27. Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
28. Garcia-Pola, M.; Llorente-Pendas, S.; Gonzalez-Garcia, M.; Garcia-Martin, J. The development of proliferative verrucous leukoplakia in oral lichen planus. A preliminary study. Med. Oral Patol. Oral y Cir. Bucal 2016, 21, e328–e334, doi:10.4317/medoral.20832.
29. McParland, H.; Warnakulasuriya, S. Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J. Oral Pathol. Med. 2021, 50, 229–235, doi:10.1111/jop.13129.
30. Carrard, V.C.; Brouns, E.R.E.A.; van der Waal, I. Proliferative verrucous leukoplakia; A critical appraisal of the diagnostic criteria. Med. Oral Patol. Oral Cir. Bucal 2013, 18, e411–e413, doi:10.4317/medoral.18912.
31. Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, 104550, doi:10.1016/j.oraloncology.2019.104550.
32. Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
33. Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
34. Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; MacDonald, L.C.; Worthington, H. V.; Mauleffinch, L.F. Limited evidence for interventions to treat oral leukoplakia. Evid. Based. Dent. 2017, 18, 92–93.
35. Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.
[/toggle]







