Questo capitolo è pensato come un’introduzione generale alla diagnosi istopatologica di disordini orali potenzialmente maligni (OPMDs) selezionati per medici, chirurghi e professionisti sanitari associati. Gli aspetti chiave discussi in questo capitolo forniranno agli operatori sanitari clinici una visione del processo di diagnosi istologica al fine di contestualizzare il ruolo del patologo nella gestione multidisciplinare degli OPMD. Non è inteso come un testo completo e discuterà le caratteristiche istologiche più comuni di OPMDs clinici, come lesioni orali lichenoidi (OLL) e displasia epiteliale orale. Le caratteristiche istologiche di altri OPMDs sono spiegate altrove.
Una diagnosi istologica accurata dipende dal contesto poiché ci sono diverse caratteristiche microscopiche sovrapponibili e non specifiche. Alcune caratteristiche microscopiche acquisiscono rilevanza in determinati contesti clinici che potrebbero altrimenti essere ignorate. Prima della valutazione microscopica, il patologo richiede:
- Informazioni demografiche importanti sui pazienti;
- la storia clinica e l’aspetto dell’OPMD;
- Esami sierologici (se necessario);
- Dettagli delle biopsie precedenti e, forse più importante;
- Una diagnosi clinica differenziale che includa il grado di sospetto clinico dell’ evoluzione maligna.
Questo evidenzia l’importanza di informazioni cliniche chiare e complete sul modulo di richiesta per l’esame istopatologico che accompagna il campione. Al contrario, i medici dovrebbero sempre considerare il referto del patologo nel loro contesto clinico; la diagnosi istologica dovrebbe corrispondere con l’impressione clinica. Una comunicazione chiara e aperta tra clinico e patologo è alla base di una gestione efficace.
Lesioni orali lichenoidi (OLL)
- Diverse condizioni infiammatorie orali tra cui lichen planus orale (OLP), reazione lichenoide (LR), lupus eritematoso (LE) e malattia rivolta contro l’ospite (GVHD) rappresentano un gruppo in quanto condividono le stesse caratteristiche istologiche.
- In molte condizioni diverse, c’è la combinazione di ipercheratosi, degenerazione delle cellule basali, corpi apoptotici (Civatte), un infiltrato infiammatorio sub-epiteliale ed esostosi linfocitaria e ciò forma il fondamento istologico di questo gruppo (Figura 1).
- Ulteriori risultati includono una disturbata architettura delle estensioni epiteliali (rete pegs), ialinizzazione della membrana basale e incontinenza pigmentaria.
- È l’alterazione dello strato di cheratina che è importante, non il tipo né la quantità. Lo strato di cheratina può presentarsi orto-cheratosico o para-cheratosico e l’estensione può variare a seconda del sito della cavità orale.
- La liquefazione delle cellule basali porta al cambiamento della squamosità basale (estensione apparente dello strato di cellule spinose alla membrana basale).
- L’infiltrato infiammatorio è di solito predominato da linfociti con pochissime cellule plasmatiche a meno che non siano presenti ulcerazioni o Candida. Tipicamente, si presenta denso e a bande con gradi variabili del tropismo epiteliale del linfocita negli strati basali delle cellule.
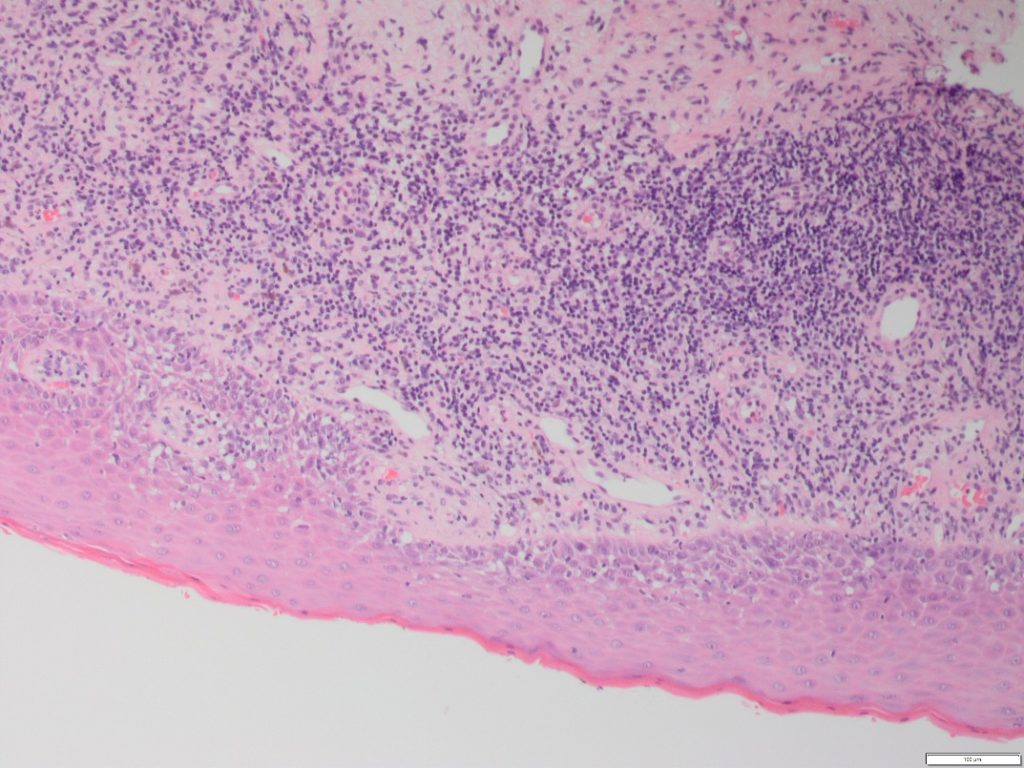
- L’analisi delle differenze istologiche tra le lesioni orali lichenoidi (OLLs) non si è dimostrata significativa, tuttavia alcune caratteristiche prediligono uno specifico OLL.
- Le lesioni lichenoidi indotte da farmaci o le lesioni lichenoidi da contatto possono presentare un’infiltrazione infiammatoria mista, con una maggiore frequenza di plasmacellule. L’esocitosi linfocitaria può anche essere osservata estendendosi sia negli strati sovra-basali sia nello strato più profondo della lamina propria con manifestazione di infiammazione perivascolare e follicoli linfoidi.
- L’iperplasia delle estensioni epiteliali con processi a forma di fiamma è associata al lupus eritematoso (LE); a volte sono così estese da formare aree di iperplasia pseudo-epiteliomatosa. Il coinvolgimento dello strato profondo della cheratina osservato nelle lesioni cutanee LE non è presente nelle lesioni del cavo orale; tuttavia può essere presente un’estensione verso il basso della cheratina, dando l’aspetto di una cheratinizzazione a basso livello.
- La OGVHD può mostrare caratteristiche istologiche identiche al lichen planus orale. L’unica caratteristica considerata più caratteristica dell’OGVHD è che l’infiltrazione linfocitaria non è così intensa e, in molti casi, assomiglia più ad un aspetto “burnt out”.
- Due criteri istologici di esclusione per tutte le lesioni orali lichenoidi sono la presenza di displasia e la presenza di un’architettura epiteliale verrucosa.
- Le lesioni orali lichenoidi come OPMDs sono stati a lungo un argomento controverso. La logica alla base di questo è che molte lesioni displastiche mostrano infiammazione lichenoide concomitante e molte lesioni lichenoidi non possono essere accuratamente valutate per la presenza di displasia, a causa degli strati alterati delle cellule basali e infiltrati linfocitari interposti. Pertanto, è essenziale considerare sempre la presenza di displasia in qualsiasi lesione lichenoide.
- L’infiammazione lichenoide è comunemente presente anche nella displasia epiteliale orale (OED), in particolare quelle che mostrano un’architettura verrucosa. È stato suggerito che questo è in risposta probabilmente alla displasia presente in queste lesioni piuttosto che una vera associazione con una lesione lichenoide sottostante.
- In uno studio di McParland e Warnakulasuriya (2021) di casi noti di leucoplachia verrucosa proliferativa, il 59% aveva ricevuto una diagnosi clinica iniziale di lichen planus orale e il 43% delle biopsie aveva mostrato caratteristiche lichenoidi.
Sebbene le lesioni orali lichenoidi condividano molte caratteristiche clinico-patologiche, sono le loro differenze ad essere estremamente importanti per la loro diagnosi e solo attraverso la comprensione della presentazione clinica, insieme a ricerche aggiuntive, possono essere fatte delle diagnosi corrette. L’interpretazione della valutazione istologica non dovrebbe mai essere fatta senza apprezzamento dell’intero contesto clinico.
Fibrosi sottomucosa orale (OSF)
- La caratteristica istologica della fibrosi sottomucosa orale è la presenza di fibrosi densa con ridotta vascolarizzazione della lamina propria. Le prime lesioni sono difficili da diagnosticare prima che la fibrosi sia marcata. Colorazioni particolari, come quella di Van Gieson, possono aiutare nella visualizzazione della disposizione parallela delle fibre di collagene.
- Anche l’ipercheratosi e l’atrofia epiteliale sono stati riportati come cambiamenti epiteliali.
- L’infiltrato infiammatorio può essere variabile e può anche mostrare un quadro infiammatorio lichenoide. È importante sottolineare che nelle biopsie è opportuno valutare la presenza di displasia epiteliale, presente fino al 15% dei casi.
Displasia epiteliale orale (OED)
L’Organizzazione mondiale della sanità (OMS) definisce l’OED come “una gamma di cambiamenti architettonici e citologici associati ad un aumentato rischio di progressione verso il carcinoma a cellule squamose”. Mentre l’OPMD è ascrivibile a presentazioni cliniche, l’OED è definito isto-morfologicamente. Pertanto, oltre all’identificazione delle caratteristiche istologiche associate a particolari disordini, il patologo prenderà in considerazione anche la presenza di displasia in qualsiasi campione di biopsia OPMD.
- I cambiamenti architettonici si riferiscono all’organizzazione disordinata del tessuto, mentre i cambiamenti citologici indicano l’anormalità delle singole cellule (Tabella 1).
- L’OMS riconosce diverse caratteristiche dell’OED, ma va notato che tali caratteristiche rimangono soggettive poiché non esistono criteri morfometrici di definizione concordati.
- Inoltre, se prese singolarmente, ogni singola caratteristica può essere presente anche in condizioni reattiva della mucosa orale. Tuttavia, queste caratteristiche servono come criteri diagnostici al patologo ed evidenziano che la lesione può avere un potenziale di evoluzione maligna.
- Oltre alle caratteristiche descritte nella tabella 1, molti aggiungerebbero anche la morfologia della superficie verrucosa, processi reticolari ripartiti, apoptosi spontanea in assenza di cellule infiammatorie intraepiteliali, ortocheratosi o para-cheratosi con demarcazione laterale e un’infiltrazione linfocitaria sub-epiteliale che imita le lesioni orali lichenoidi.
- Alcuni gruppi utilizzano anche il termine displasia differenziata, vale a dire l’espansione del compartimento sovra-basale per la presenza di grandi cellule con abbondante citoplasma eosinofilo ed edema intercellulare. Queste ultime caratteristiche architettoniche sono spesso scambiate per cambiamenti iperplastici reattivi.
| Cambiamenti architettonici | Cambiamenti citologici |
| Stratificazione irregolare | Variazione anormale nella dimensione nucleare |
| Perdita di polarità delle cellule basali | Variazione anormale nella forma nucleare |
| Processi reticolari bulbosi | Variazione anormale nella dimensione delle cellule |
| Aumento del numero di figure mitotiche | Variazione anormale nella forma delle cellule |
| Cheratinizzazione prematura in una singola cellula | Aumento del rapporto nucleo/citoplasma |
| Vortici squamosi all’interno delle creste della rete | Figure mitotiche atipiche |
| Perdita di coesione intracellulare | Numero e dimensione aumentati di nucleoli |
| x | Ipercromasia |
Tabella 1. Criteri morfologici OMS modificati di OED. Anche la morfologia della superficie verrucosa, suddivisione dei processi reticolari, l’apoptosi spontanea, il quadro di cheratosi demarcato e la proliferazione sovra-basale sono caratteristiche sempre più accettate.
Attualmente, c’è una mancanza di prova per dimostrare che la presenza di ogni singola caratteristica è significativa nella previsione della trasformazione maligna. Inoltre, sembra esserci una correlazione relativamente scarsa tra aberrazioni genetiche e cambiamenti morfologici. Pertanto, quando si valuta la displasia, piuttosto che applicare qualsiasi approccio algoritmico basato su punti, i patologi intraprendono una panoramica globale dei cambiamenti epiteliali, tenendo conto della valutazione intraorale e della sua presentazione clinica.
- C’è una correlazione positiva fra la probabilità e il timing di trasformazione maligna e i gradi aumentanti di displasia. Tuttavia, i valori predittivi pubblicati di trasformazione maligna hanno ampi intervalli di confidenza a causa della scarsa riproducibilità inter-osservatore, eterogeneità metodologica e periodi di follow-up variabili.
- I valori predittivi possono essere migliorati utilizzando la ploidia e la perdita di eterozigosi in aggiunta alla classificazione istologica, ma questi non sono attualmente disponibili al di là di centri altamente specializzati o di ricerca.
- Poiché l’OED è una gamma di cambiamenti morfologici, la classificazione istologica della displasia è essenziale per la successiva gestione di qualsiasi OPMD.
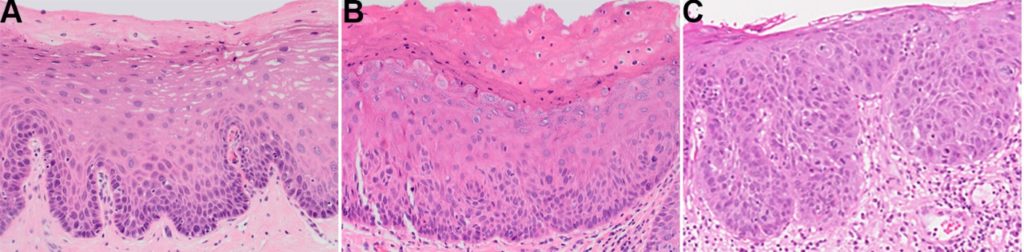
- La maggior parte dei centri utilizza un sistema di classificazione a tre livelli per l’OED: displasia lieve, moderata e grave (figura 2) con il carcinoma in situ che è sinonimo di quest’ultimo.
- Questo sistema è parzialmente guidato dallo spessore epiteliale suddiviso in terzi colpiti da cambiamenti architettonici e citologici. Tuttavia, va sottolineato che la displasia lieve, moderata e grave non equivale necessariamente a cambiamenti limitati rispettivamente ai terzi basali, medi e superficiali dell’epitelio. Ad esempio, è possibile che la displasia sia classificata come grave nonostante i cambiamenti siano limitati al terzo basale; ciò evidenzia come la classificazione sia una valutazione globale dei cambiamenti morfologici.
- Tuttavia, poiché i cut-off tra ogni grado sono scarsamente definiti, la riproducibilità inter-osservatore non è ottimale.
- Per superare questo problema, alcuni autori suggeriscono un sistema di classificazione binaria (alto e basso grado) con criteri di cut-off tra i gradi.
- In futuro, la riproducibilità può essere migliorata incorporando piattaforme di intelligenza artificiale.
- In definitiva, l’obiettivo di qualsiasi sistema di classificazione non è la riproducibilità, ma informare la gestione clinica all’interno di un contesto multidisciplinare.
- L’intenzione del patologo di assegnare un grado dovrebbe essere chiara al clinico indipendentemente dal sistema utilizzato, sottolineando ulteriormente la necessità di buone relazioni di lavoro multidisciplinari per una gestione efficace degli OPMDs.
Le lesioni ipercheratosiche spesso contengono contemporaneamente infezioni da Candida spp. . La risposta epiteliale squamosa reattiva (e quindi reversibile) alle ife fungine provoca cambiamenti fenotipici che sono indistinguibili dalla displasia. In tali circostanze, sarebbe prudente considerare la classificazione istologica definitiva dell’OED in seguito all’eliminazione dell’infezione da candida, alla nuova valutazione clinica e/o alla nuova biopsia.
Papillomavirus umano - associato a displasia epiteliale orale (HPV OED)
- Un sottogruppo di OED è noto per essere associato a diversi tipi di papillomavirus umano (HPV) ad alto rischio, principalmente HPV-16.
- Il virus induce cambiamenti isto-morfologici piuttosto distinti dell’epitelio, come cariorressi, cheratinociti apoptotici sovra-basali isolati, forme mitotiche abortive (corpi mitosoidi) e variabili cellule simili a coilociti all’interno degli strati superficiali.
- Queste caratteristiche morfologiche da sole non sono sufficientemente specifiche per confermare un’eziologia condotta dal virus; è necessario un test per HPV trascrizionalmente attivo ad alto rischio.
- La presenza di HPV ad alto rischio può essere dimostrata con una forte e diffusa positività di blocco per il P16 (spesso con demarcazione laterale) seguita da ibridazione in situ per DNA o RNA virali.
- In assenza di cambiamenti citopatici virali, i test per HPV mediante la sola PCR, non sono sufficientemente specifici per l’HPV OED.
- I rapporti aneddotici di evoluzione maligna in HPV OED sono stati riportati in piccole serie di casi, ma i tassi di trasformazione maligni complessivi rimangono attualmente sconosciuti.
- Poiché non esiste un sistema di classificazione accettato, l’HPV OED dovrebbe per il momento essere classificato e gestito clinicamente secondo i criteri convenzionali.
Referenze e ulteriori letture
Alberdi-Navarro, J., et al., Histopathological characterization of the oral lichenoid disease subtypes and the relation with the clinical data. Med Oral Patol Oral Cir Bucal, 2017. 22(3): p. e307-e313.
Arsenic, R. and M.O. Kurrer, Differentiated dysplasia is a frequent precursor or associated lesion in invasive squamous cell carcinoma of the oral cavity and pharynx. Virchows Arch, 2013. 462(6): p. 609-17.
Cai, X., et al., Oral submucous fibrosis: A clinicopathological study of 674 cases in China. J Oral Pathol Med, 2019. 48(4): p. 321-325.
Cheng, Y.S., et al., Diagnosis of oral lichen planus: a position paper of the American Academy of Oral and Maxillofacial Pathology. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016. 122(3): p.
Davidova, L.A., et al., Lichenoid Characteristics in Premalignant Verrucous Lesions and Verrucous Carcinoma of the Oral Cavity. Head Neck Pathol, 2019. 13(4): p. 573-579.
de la Cour, C.D., et al., Human papillomavirus prevalence in oral potentially malignant disorders: Systematic review and meta-analysis. Oral Dis, 2021. 27(3): p. 431-438.
Fitzpatrick, S.G., et al., Histologic lichenoid features in oral dysplasia and squamous cell. Oral Surg Oral Med Oral Pathol Oral Radiol. 2014 Apr;117(4):511-20.
Fonseca-Silva, T., et al., Association between histopathological features of dysplasia in oral leukoplakia and loss of heterozygosity. Histopathology, 2016. 68(3): p. 456-60.
Iocca, O., et al., Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck, 2020. 42(3): p. 539-555.
Lu, R. and G. Zhou, Oral lichenoid lesions: Is it a single disease or a group of diseases? Oral Oncol, 2021. 117: p. 105188.
Khanal, S., et al., Histologic variation in high grade oral epithelial dysplasia when associated with high-risk human papillomavirus. Oral Surg Oral Med Oral Pathol Oral Radiol, 2017. 123(5): p. 566-585.
Kujan, O., et al., Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol, 2006. 42(10): p. 987-93.
Lerman, M.A., et al., HPV-16 in a distinct subset of oral epithelial dysplasia. Mod Pathol, 2017. 30(12): p. 1646-1654.
McCord, C., et al., Association of high-risk human papillomavirus infection with oral epithelial dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013. 115(4): p. 541-9.
McParland, H. and S. Warnakulasuriya, Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J Oral Pathol Med, 2021. 50(2): p. 229-235.
Mahmood, H., et al., Use of artificial intelligence in diagnosis of head and neck precancerous and cancerous lesions: A systematic review. Oral Oncol, 2020. 110: p. 104885.
Mehanna, H.M., et al., Treatment and follow-up of oral dysplasia – a systematic review and meta-analysis. Head Neck, 2009. 31(12): p. 1600-9.
Muller, S., Oral lichenoid lesions: distinguishing the benign from the deadly. Mod Pathol. 2017 Jan;30(s1):S54-S67.
Nankivell, P., et al., The binary oral dysplasia grading system: validity testing and suggested improvement. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013. 115(1): p. 87-94.
Nishat, R. and H. Kumar, Collagen fibers in oral submucous fibrosis – A polarizing microscopy study using two special stains. Indian J Pathol Microbiol, 2019. 62(4): p. 537-543.
Odell, E., et al., Oral epithelial dysplasia: recognition, grading and clinical significance. Oral Dis, 2021.
Odell, E.W., et al., Precursor Lesions for Squamous Carcinoma in the Upper Aerodigestive Tract, in Gnepp’s Diagnostic Surgical Pathology of the Head and Neck, D. Gnepp and B.J. A., Editors. 2020, Elsevier.
Odell, E.W., Aneuploidy and loss of heterozygosity as risk markers for malignant transformation in oral mucosa. Oral Dis. 2021 Nov;27(8):1993-2007.
Reibel, J., et al., Oral potentially malignant disorders and oral epithelial dysplasia, in WHO Classification of Head and Neck Tumours 4th edition, World Health Organisation Classification of Tumours, A.K. El Naggar, et al., Editors. 2017, IARC: Lyon, France.
Wils, L.J., et al., Incorporation of differentiated dysplasia improves prediction of oral leukoplakia at increased risk of malignant progression. Mod Pathol, 2020. 33(6): p. 1033-1040.
Woo, S.B., Oral Epithelial Dysplasia and Premalignancy. Head Neck Pathol, 2019. 13(3): p. 423-439.







