Este capítulo pretende ser uma introdução geral ao diagnóstico histopatológico de alterações orais potencialmente malignas (OPMDs) selecionados para médicos, cirurgiões e profissionais de saúde. Espera-se que os principais aspetos discutidos neste capítulo forneçam uma visão sobre o processo de diagnóstico histológico aos profissionais de saúde, a fim de contextualizar o papel do patologista na gestão multidisciplinar das OPMDs. Não pretende ser um texto abrangente e discutirá as características histológicas mais comuns das OPMDs clínicas, ou seja, lesões liquenoides orais (LLO) e a displasia epitelial oral. As características histológicas de outras OPMDs são abordadas noutra secção.
Um diagnóstico histológico preciso depende do contexto, uma vez que existem várias características microscópicas sobrepostas e inespecíficas. Algumas características microscópicas ganham relevância em certos contextos clínicos que, de outra forma, podem ser consideradas como incidentais. Antes da avaliação microscópica, o patologista requer:
- Informações demográficas relevantes do paciente;
- O historial clínico e ocorrências anteriores de OPMD;
- Resultados serológicos (se aplicável);
- Detalhes de biópsias anteriores e;
- Talvez o mais importante, um diagnóstico diferencial clínico, incluindo o grau de suspeita clínica de transformação maligna.
Destaca-se a importância de informações clínicas claras e extensas no formulário de solicitação de patologia que acompanha a amostra. Os médicos devem sempre considerar o relatório de patologia no seu contexto clínico; o diagnóstico histológico deve complementar, e não contradizer, a impressão clínica. A comunicação clara e aberta entre o médico e os patologistas leva a um tratamento eficaz.
Lesões Liquenoides Orais (LLO)
- Grupo diversificado de condições inflamatórias orais incluindo, mas não limitado a: líquen plano oral (LPO), reação liquenoide (RL), lúpus eritematoso (LE) e Doença do Enxerto contra o Hospedeiro (DEcH), agrupados de acordo com as suas características histológicas partilhadas.
- Observada individualmente num grande número de condições distintas, é a combinação de hiperqueratose, degeneração basocelular, corpos apoptóticos (Civatte), infiltrado inflamatório subepitelial e exostose de linfócitos que formam a base histológica desse grupo (Figura 1).
- Descobertas adicionais podem incluir uma aparência alterada das cristas interpapilares, hialinização da membrana basal e incontinência pigmentar.
- É a alteração na camada de queratina, e não o tipo nem a quantidade, que é importante. A camada de queratina pode apresentar-se como orto ou paraqueratina e a extensão pode variar dependendo do local da cavidade oral.
- A liquefação das células basais leva à alteração basal escamosa (extensão aparente da camada das células escamosas da membrana basal).
- O infiltrado inflamatório é geralmente constituído predominantemente por linfócitos com muito poucas células plasmáticas, a menos que estejam presentes ulceração ou Candida. Tipicamente, é denso e em forma de faixa, com graus variados de tropismo epitelial de linfócitos nas camadas de células basais.
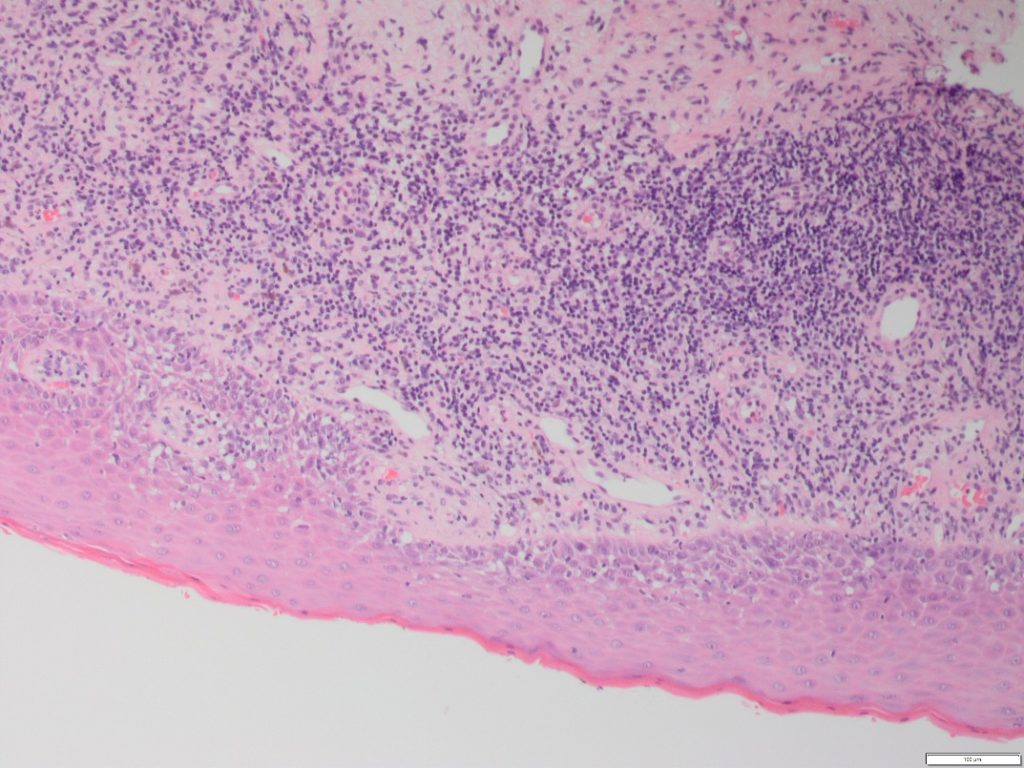
- A análise das diferenças histológicas entre as LLOs não se mostra significativa. No entanto, algumas características são muitas vezes consideradas como favoráveis a uma LLO específica.
- As reações liquenoides orais por contacto e por ingestão de fármacos podem demonstrar um infiltrado inflamatório difuso misto com maior frequência de plasmócitos. A exocitose de linfócitos também pode ser observada estendendo-se tanto para as camadas suprabasais quanto para a lâmina própria mais profunda, com demonstração de inflamação perivascular e folículos linfoides.
- A hiperplasia das cristas interpapilares em forma de chama está associada à excitose de linfócitos, ocasionalmente extensa o suficiente para formar áreas de hiperplasia pseudoepiteliomatosa. Não se observa, nas lesões da cavidade oral, o tampão profundo de queratina visto nas lesões de pele associadas à excitose de linfócitos; no entanto, pode verificar-se a extensão da queratina a jusante, dando a aparência de queratinização de baixo nível.
- A Doença do Enxerto contra o Hospedeiro (DEcH) oral pode apresentar características histológicas idênticas ao líquen plano oral. A única característica regularmente considerada mais sugestiva de DEcH oral é que o infiltrado linfocitário não é tão intenso e, em muitos casos, assemelha-se mais a uma aparência “queimada”.
- Dois critérios de exclusão histológica para todas as lesões liquenoides orais são a presença de displasia e uma arquitetura epitelial verrucosa.
- Enquanto OPMDs, as LLOs têm sido um tópico controverso. A lógica justificativa é que muitas lesões displásicas mostram inflamação liquenoide concomitante e muitas lesões liquenoides não podem ser avaliadas com precisão quanto à presença de displasia, devido às camadas de células basais alteradas e infiltrado linfocitário misto. Portanto, é fundamental considerar sempre a presença de displasia em qualquer lesão liquenoide.
- É comum verificar-se inflamação liquenoide na displasia epitelial oral (DEO), em particular naquelas que demonstram arquitetura verrucosa. Tem sido sugerido que, provavelmente, será uma resposta à displasia dentro dessas lesões, em vez de estar realmente associada a uma lesão liquenoide subjacente.
- Num estudo de McParland e Warnakulasuriya (2021) de casos conhecidos de leucoplasia verrucosa proliferativa, 59% receberam um diagnóstico clínico inicial de LPO e 43% das biópsias mostraram características liquenoides.
Embora as LLOs compartilhem muitas características clinicopatológicas, são as suas diferenças que são extremamente importantes no diagnóstico. Um diagnóstico correto pode ser conseguido apenas através da compreensão da apresentação clínica, em conjunto com resultados adicionais. A avaliação histológica nunca deve ser interpretada sem ser considerado o contexto clínico completo.
Fibrose Submucosa Oral (FSO)
- A característica histológica da fibrose submucosa oral é a presença de fibrose densa com vascularização reduzida da lâmina própria. Lesões precoces podem ser difíceis de diagnosticar antes da presença de fibrose. Colorações especiais, como a de Van Gieson, podem ajudar na visualização das fibras de colagénio dispostas paralelamente.
- Hiperqueratose e atrofia epitelial também foram relatadas como alterações epiteliais.
- O infiltrado inflamatório pode ser variável e até apresentar um padrão inflamatório liquenoide. É importante ressaltar que as biópsias devem ser avaliadas quanto à presença de displasia epitelial, que é observada em até 15% dos casos.
Displasia Epitelial Oral (DEO)
A Organização Mundial da Saúde (OMS) define a DEO como “um espectro de alterações da arquitetura e da citologia associadas a um risco aumentado de progressão para carcinoma de células escamosas”. Enquanto uma OPMD é atribuída a manifestações clínicas, a DEO é definida histomorfologicamente. Portanto, para além da identificação de características histológicas associadas a alterações específicas, o patologista também deverá considerar a presença de displasia em qualquer amostra de biópsia de uma OPMD.
- As alterações da arquitetura referem-se à organização tecidual desordenada, enquanto as alterações citológicas indicam anormalidade celular individual (Tabela 1).
- A OMS reconhece várias características da DEO, mas deve ressalvar-se que permanecem subjetivas, uma vez que não existem critérios morfométricos distintivos acordados.
- Acresce que, quando considerada isoladamente, cada característica individual pode também estar presente em condições reativas da mucosa oral. No entanto, essas características servem como critérios diagnósticos e destacam o potencial para transformação maligna da lesão.
- Além das características apresentadas na Tabela 1, muitos acrescentariam a morfologia da superfície verrucosa, cristas interpapilares subdivididas ou em alongamento, apoptose espontânea na ausência de células inflamatórias intraepiteliais, orto ou paraqueratose com demarcação lateral abrupta e infiltrado linfocitário subepitelial, imitando o comportamento das LLOs.
- Alguns grupos também utilizam o termo “displasia diferenciada”, ou seja, expansão do compartimento suprabasal por grandes células com citoplasma eosinofílico abundante e edema intercelular. Estas últimas características são frequentemente confundidas com alterações hiperplásicas reativas.
| Alterações na arquitetura | Alterações citológicas |
| Estratificação irregular | Variação anormal no tamanho do núcleo |
| Perda de polaridade das células basais | Variação anormal na forma do núcleo |
| Cristas interpapilares bulbosas | Variação anormal no tamanho das células |
| Aumento do número de figuras mitóticas | Variação anormal no formato das células |
| Queratinização prematura numa única célula | Aumento da razão núcleo:citoplasma |
| Remoinhos escamosos entre as cristas interpapilares | Figuras mitóticas atípicas |
| Perda de coesão intracelular | Aumento do número e tamanho dos nucléolos |
| Hipercromasia |
Tabela 1. Critérios morfológicos da DEO da OMS modificados. Morfologia da superfície verrucosa, cristas interpapilares subdivididas, apoptose espontânea, padrão de demarcação abrupta de queratose e proliferação suprabasal volumosa são características cada vez mais aceites.
Atualmente, não há evidências que indiquem que qualquer característica única deva ter maior significância na previsão de transformação maligna. Adicionalmente, parece haver uma correlação relativamente fraca entre as alterações genéticas e morfológicas. Portanto, ao avaliar a displasia, em vez de aplicar qualquer abordagem algorítmica baseada em pontos, os patologistas deverão ter uma visão global das alterações epiteliais, tendo em consideração a subregião intraoral e a sua apresentação clínica.
- Existe uma correlação positiva entre a probabilidade e o tempo de transformação maligna com graus crescentes de displasia. No entanto, os valores esperados de transformação maligna publicados têm intervalos de confiança amplos dada a baixa reprodutibilidade interobservador, heterogeneidade metodológica e períodos de acompanhamento variáveis.
- Os valores esperados podem ser melhorados através de análises da ploidia e perda de heterozigosidade como complemento da classificação histológica, não estando atualmente disponíveis fora de centros altamente especializados ou de centros de pesquisa.
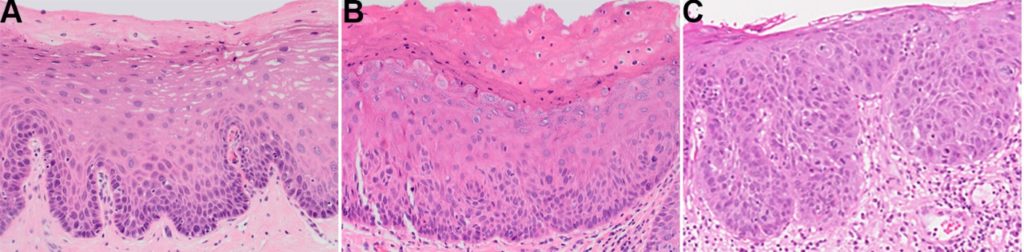
- Como a DEO é um espectro de alterações morfológicas, a classificação histológica da displasia é essencial para informar sobre a gestão subsequente de qualquer OPMD.
- A maioria dos centros utiliza um sistema de classificação de três níveis para a DEO: leve, moderada e grave (Figura 2), sendo o carcinoma in situ sinónimo do último.
- Este sistema é parcialmente guiado pela espessura epitelial em terços afetados pela alteração da arquitetura e da citologia. No entanto, deve ser notado que tipos de displasia leve, moderada e grave não necessariamente equivalem a alterações limitadas aos terços basal, médio e superficial do epitélio, respetivamente. Por exemplo, é possível que a displasia seja classificada como grave apesar das alterações serem limitadas ao terço basal, destacando a graduação como avaliação global das alterações morfológicas.
- No entanto, como os pontos de corte entre cada grau são mal definidos, a reprodutibilidade interobservador abaixo do ideal é exposta.
- Para ultrapassar esta questão, algumas autoridades defendem um sistema de classificação binário (alto e baixo grau) e sugerem critérios de corte entre os graus.
- No futuro, a reprodutibilidade pode ser aprimorada pela incorporação de plataformas de inteligência artificial.
- Em última análise, o objetivo de qualquer sistema de classificação não é a reprodutibilidade, mas informar sobre a gestão clínica dentro de um contexto multidisciplinar.
- A intenção do patologista em atribuir uma nota deve ficar clara para o médico, independentemente do sistema usado, enfatizando ainda mais a necessidade de boas relações de trabalho multidisciplinares para o tratamento eficaz das OPMDs.
Frequentemente, as lesões hiperqueratóticas contêm infeções concomitantes por Candida spp.. A resposta epitelial escamosa reativa (e, portanto, reversível) hifa fúngica resulta em alterações fenotípicas que são indistinguíveis da displasia. Em tais circunstâncias, seria prudente considerar a classificação histológica definitiva da DEO após a eliminação da infeção por Candida, reavaliação clínica e/ou repetição da biópsia.
Papilomavírus Humano - Displasia Epitelial Oral Associada (HPV DEO)
- Sabe-se que um subconjunto de DEO está associado a tipos de papilomavírus humano (HPV) de alto risco, principalmente o HPV-16.
- O vírus induz alterações epiteliais histomorfológicas distintas, nomeadamente carriorrexe, queratinócitos apoptóticos suprabasais isolados, formas mitóticas abortivas (corpos mitosoides) e células semelhantes a coilócitos dentro dos estratos superficiais.
- Estas características morfológicas são insuficientemente específicas, por si só, para confirmar uma etiologia causada por vírus, sendo necessário realizar testes para HPV de alto risco transcricionalmente ativo.
- A presença de HPV de alto risco biologicamente significativo pode ser demonstrada através de um teste de positividade forte e difusa de bloqueio para p16 (muitas vezes com demarcação lateral nítida) seguida de hibridização in situ para ADN ou RNA viral.
- Na ausência de alterações citopáticas virais, o teste de HPV por PCR de consenso por si só não é suficientemente específico para detetar HPV na DEO.
- Há evidências que sugerem a possibilidade de progressão do HPV na DEO para carcinoma, tendo sido relatadas em pequenas séries de casos. As taxas gerais de transformação maligna permanecem ainda desconhecidas.
- Como não existe um sistema de classificação transversalmente aceite, o HPV DEO deve, para já, ser classificado e controlado clinicamente seguindo os critérios convencionais.
Read more
Alberdi-Navarro, J., et al., Histopathological characterization of the oral lichenoid disease subtypes and the relation with the clinical data. Med Oral Patol Oral Cir Bucal, 2017. 22(3): p. e307-e313.
Arsenic, R. and M.O. Kurrer, Differentiated dysplasia is a frequent precursor or associated lesion in invasive squamous cell carcinoma of the oral cavity and pharynx. Virchows Arch, 2013. 462(6): p. 609-17.
Cai, X., et al., Oral submucous fibrosis: A clinicopathological study of 674 cases in China. J Oral Pathol Med, 2019. 48(4): p. 321-325.
Cheng, Y.S., et al., Diagnosis of oral lichen planus: a position paper of the American Academy of Oral and Maxillofacial Pathology. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016. 122(3): p.
Davidova, L.A., et al., Lichenoid Characteristics in Premalignant Verrucous Lesions and Verrucous Carcinoma of the Oral Cavity. Head Neck Pathol, 2019. 13(4): p. 573-579.
de la Cour, C.D., et al., Human papillomavirus prevalence in oral potentially malignant disorders: Systematic review and meta-analysis. Oral Dis, 2021. 27(3): p. 431-438.
Fitzpatrick, S.G., et al., Histologic lichenoid features in oral dysplasia and squamous cell. Oral Surg Oral Med Oral Pathol Oral Radiol. 2014 Apr;117(4):511-20.
Fonseca-Silva, T., et al., Association between histopathological features of dysplasia in oral leukoplakia and loss of heterozygosity. Histopathology, 2016. 68(3): p. 456-60.
Iocca, O., et al., Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck, 2020. 42(3): p. 539-555.
Lu, R. and G. Zhou, Oral lichenoid lesions: Is it a single disease or a group of diseases? Oral Oncol, 2021. 117: p. 105188.
Khanal, S., et al., Histologic variation in high grade oral epithelial dysplasia when associated with high-risk human papillomavirus. Oral Surg Oral Med Oral Pathol Oral Radiol, 2017. 123(5): p. 566-585.
Kujan, O., et al., Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol, 2006. 42(10): p. 987-93.
Lerman, M.A., et al., HPV-16 in a distinct subset of oral epithelial dysplasia. Mod Pathol, 2017. 30(12): p. 1646-1654.
McCord, C., et al., Association of high-risk human papillomavirus infection with oral epithelial dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013. 115(4): p. 541-9.
McParland, H. and S. Warnakulasuriya, Lichenoid morphology could be an early feature of oral proliferative verrucous leukoplakia. J Oral Pathol Med, 2021. 50(2): p. 229-235.
Mahmood, H., et al., Use of artificial intelligence in diagnosis of head and neck precancerous and cancerous lesions: A systematic review. Oral Oncol, 2020. 110: p. 104885.
Mehanna, H.M., et al., Treatment and follow-up of oral dysplasia – a systematic review and meta-analysis. Head Neck, 2009. 31(12): p. 1600-9.
Muller, S., Oral lichenoid lesions: distinguishing the benign from the deadly. Mod Pathol. 2017 Jan;30(s1):S54-S67.
Nankivell, P., et al., The binary oral dysplasia grading system: validity testing and suggested improvement. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013. 115(1): p. 87-94.
Nishat, R. and H. Kumar, Collagen fibers in oral submucous fibrosis – A polarizing microscopy study using two special stains. Indian J Pathol Microbiol, 2019. 62(4): p. 537-543.
Odell, E., et al., Oral epithelial dysplasia: recognition, grading and clinical significance. Oral Dis, 2021.
Odell, E.W., et al., Precursor Lesions for Squamous Carcinoma in the Upper Aerodigestive Tract, in Gnepp’s Diagnostic Surgical Pathology of the Head and Neck, D. Gnepp and B.J. A., Editors. 2020, Elsevier.
Odell, E.W., Aneuploidy and loss of heterozygosity as risk markers for malignant transformation in oral mucosa. Oral Dis. 2021 Nov;27(8):1993-2007.
Reibel, J., et al., Oral potentially malignant disorders and oral epithelial dysplasia, in WHO Classification of Head and Neck Tumours 4th edition, World Health Organisation Classification of Tumours, A.K. El Naggar, et al., Editors. 2017, IARC: Lyon, France.
Wils, L.J., et al., Incorporation of differentiated dysplasia improves prediction of oral leukoplakia at increased risk of malignant progression. Mod Pathol, 2020. 33(6): p. 1033-1040.
Woo, S.B., Oral Epithelial Dysplasia and Premalignancy. Head Neck Pathol, 2019. 13(3): p. 423-439.







