Leucoplasia
Se han sugerido varias definiciones para la leucoplasia oral (LO) y esto ha evolucionado continuamente durante los últimos 40 años (Tabla 1). La definición más reciente y ampliamente aceptada fue propuesta por el Centro Colaborador de la OMS para el Cáncer Oral en 2007 y reconfirmada en 2020. La leucoplasia se define como “placas blancas con riesgo de trasformación maligna cuestionable, habiendo excluido otras enfermedades o trastornos conocidos que no presentan riesgo de cáncer»
El término leucoplasia se utiliza cuando se ha excluido cualquier otro trastorno de la mucosa oral que pueda presentarse como una lesión blanca (p. ej., queratosis friccional, liquen plano, nevus esponjoso blanco, leucoplasia vellosa, etc.). Por definición, la leucoplasia es una entidad clínica, diagnosticada por exclusión y no tiene un componente histopatológico específico.
Epidemiología y Factores de Riesgo para el Desarrollo de la Leucoplasia Oral
Epidemiología:
- Comúnmente diagnosticada en pacientes de mediana edad o edad avanzada.
- Más comúnmente identificada en hombres.
- Hasta seis veces más frecuente entre los fumadores que en los no fumadores.
- La prevalencia varía significativamente según la distribución geográfica debido a diferentes factores de riesgo, como masticar nuez de betel en el sur y sudeste asiático.
Factores de Riesgo:
- Se asocia con varios factores de riesgo, similares a los observados en el cáncer oral, como el tabaco (tanto fumado como sin humo), el consumo excesivo de alcohol, la masticación de betel quid (especialmente en los países del sur y sudeste de Asia) y, para lesiones que involucran el labio, la exposición a la radiación ultravioleta
- El consumo de alcohol es un factor de riesgo independiente. Se ha establecido que estos factores pueden tener un papel etiológico en el desarrollo de la leucoplasia oral en más del 75% de los pacientes.
Presentación clínica
- La leucoplasia oral puede afectar cualquier localización de la cavidad oral y puede ser uni o multifocal. Sin embargo, en las poblaciones occidentales industrializadas, las localizaciones más comunes son el borde lateral de la lengua y el suelo de boca.
- En las poblaciones asiáticas, debido al consumo frecuente de betel quid, la leucoplasia oral suele localizarse en las mucosas bucal y labial.
- Clínicamente, la leucoplasia muestra una amplia gama de características clínicas, variables en color (blanco y mezcla de blanco y rojo), superficie (placa/meseta, granular, atrófica), textura (lisa, corrugada, granular verrugosa) (blanda, firme o endurada) y tamaño y forma.
- La extensión clínica de la leucoplasia oral puede variar en tamaño desde una lesión relativamente pequeña y bien delimitada hasta una lesión extensa que afecta una gran área de la mucosa oral.
La leucoplasia oral se puede subclasificar clínicamente en dos tipos: homogénea y no homogénea. Figuras 1 y 2.
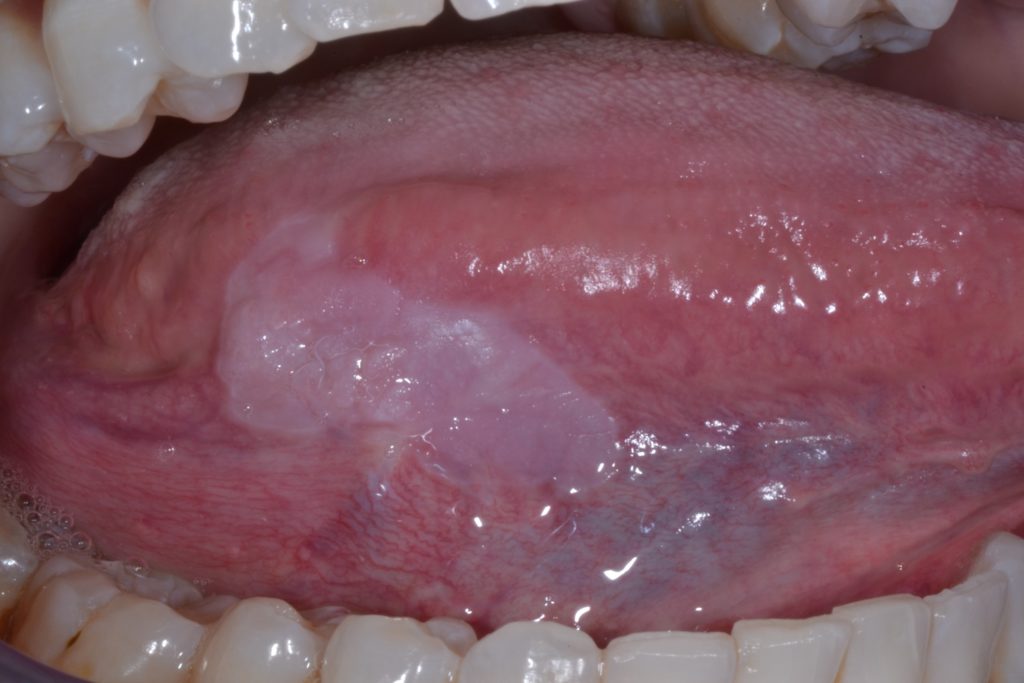
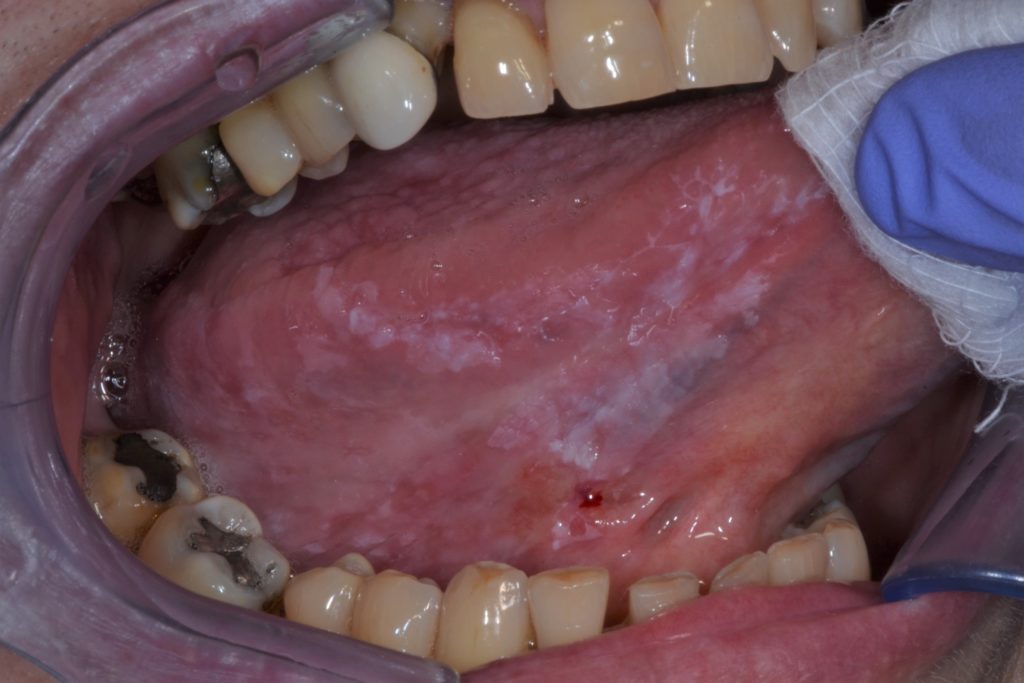
Esta distinción es puramente clínica, basada en distintas características como el color, la superficie, y la textura: leucoplasia homogénea y leucoplasia no homogénea (tabla 2).
| Leucoplasia Oral | |
| Leucoplasia homogénea | Leucoplasia no homogénea |
| Placa/parche blanco uniforme, plano y delgado con márgenes bien definidos, superficie lisa asociada con grietas/fisuras poco profundas. No se puede raspar. | Moteada: color mixto blanco y rojo Nodular: pequeñas excrecencias polipoides redondeadas rojas o blancas Verrugosa: superficie arrugada o corrugada. No se puede raspar. |
Tabla 2: Clasificación de la leucoplasia oral basada en las distintas características clínicas
Leucoplasia homogénea:
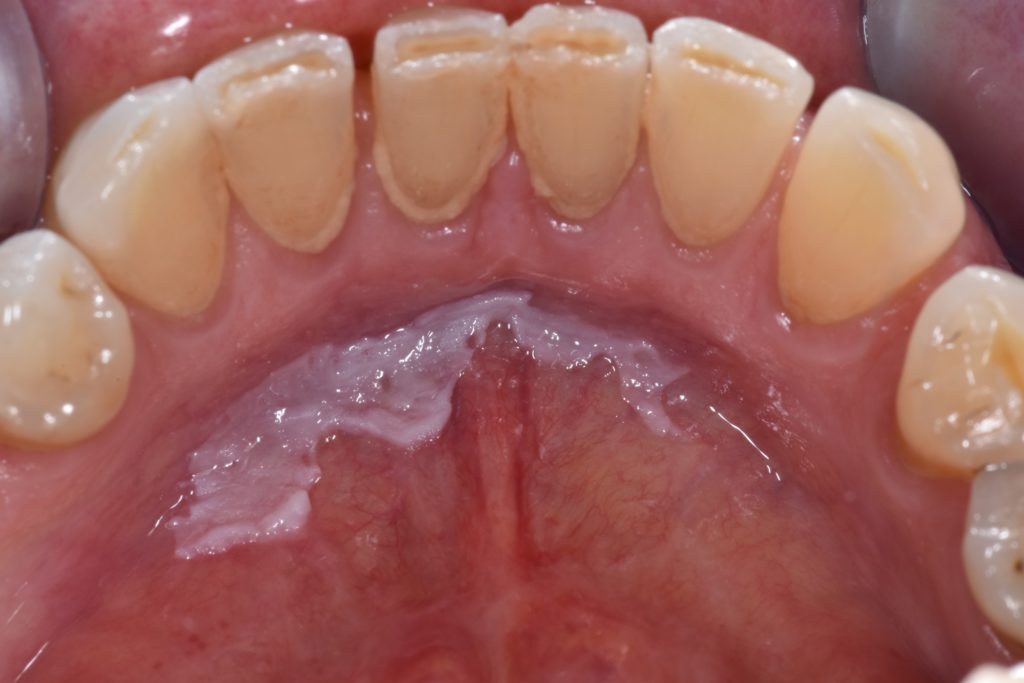
- Se caracteriza por una placa/parche blanca uniforme, plana y delgada con márgenes bien definidos y una superficie lisa que puede estar asociada con grietas/fisuras poco profundas de la queratina superficial. Ilustrado en la Figura 3.
Leucoplasia no homogénea:
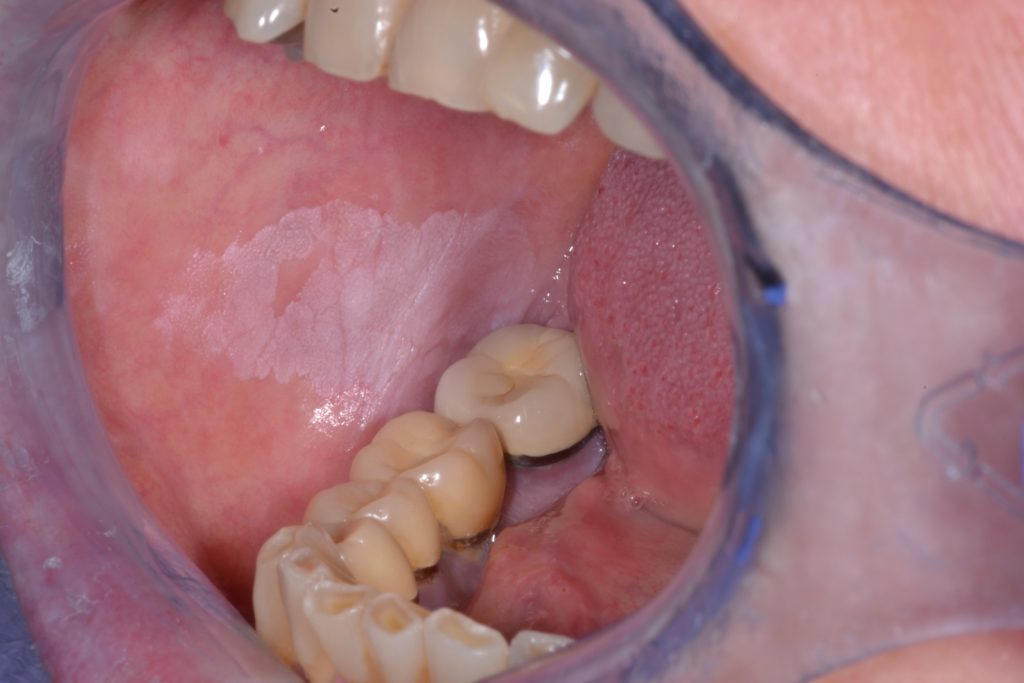
- Se caracterizado por una textura irregular, que puede incluir ulceración superficial focal y márgenes mal definidos. La leucoplasia no homogénea puede estar asociada con diferentes aspectos clínicos utilizados para su descripción: se ilustra con más detalle en las Figuras 4 y 5.
- Moteada: mezcla de color blanco y rojo pero manteniendo una coloración predominantemente blanca (también definida como eritroleucoplasia)
- Nodular: pequeñas proyecciones polipoides redondeadas, rojas o blancas.
- Verrugosa o exofítica: apariencia de superficie arrugada o corrugada
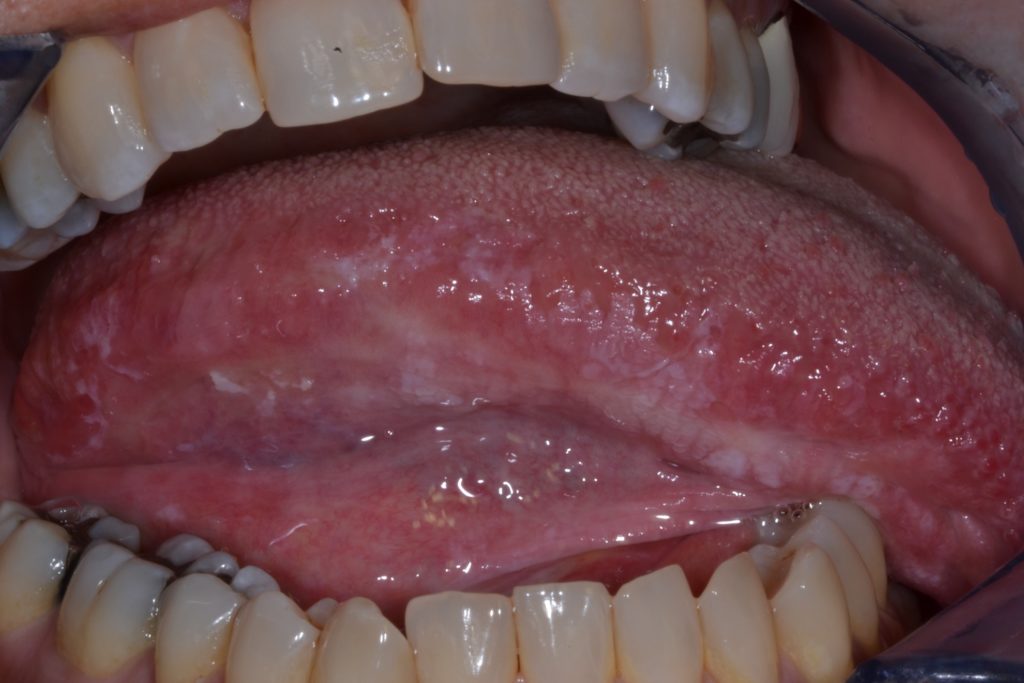
- Las leucoplasias son generalmente asintomáticas y a menudo son un hallazgo casual durante el examen general de rutina.
- Las leucoplasias homogéneas suelen ser asintomáticas.
- Los síntomas son raros y, si están presentes, generalmente se asocian con las formas no homogéneas que pueden mostrar una ulceración superficial focal.
- Los síntomas descritos con mayor frecuencia son molestias ligeras, hormigueo y sensibilidad al tacto o a las bebidas calientes o comidas picantes.
Riesgo de Aparición de Cáncer
Carcinoma Oral de Células Escamosas:
- El carcinoma oral de células escamosas (COCE) es la neoplasia maligna más frecuente de la cavidad oral
- El COCE generalmente afecta a hombres mayores de 60 años; sin embargo, recientemente la prevalencia ha aumentado en los menores de 40 años.
- El COCE puede presentarse como una úlcera que no cicatriza, una masa en crecimiento con una superficie irregular y lesiones rojas o blancas en la mucosa oral.
Leukoplasia:
- Las leucoplasias se clasifican como trastornos orales potencialmente malignos que predisponen a los individuos afectados a un mayor riesgo de desarrollar un carcinoma oral de células escamosas.
- La leucoplasia oral muestra porcentajes variables de progresión a un COCE, que van desde el 0% hasta el 36,4%. La tasa anual de transformación oscila entre el 0,3 % y el 6,9 % por año, según lo encontrado en una revisión reciente de estudios observacionales.
- Los factores de riesgo, que han mostrado significación estadística, para el desarrollo de cáncer en individuos afectados por leucoplasias orales se enumeran en la tabla 4.
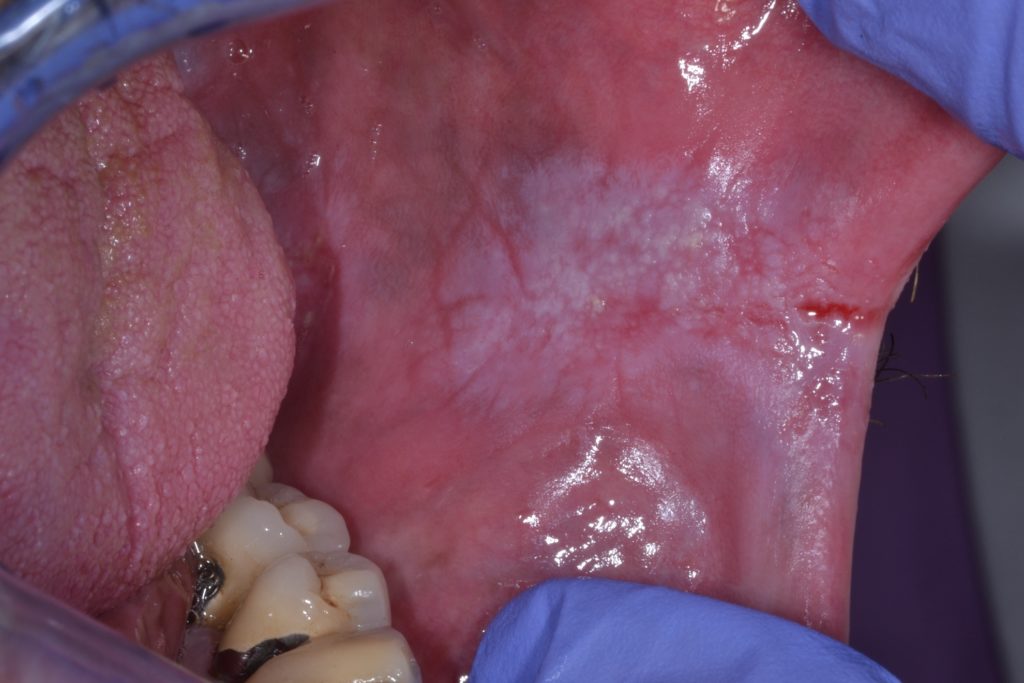
- La figura 6 ilustra una leucoplasia en suelo de boca, considerada una localización de alto riesgo debido a la acumulación de carcinógenos.
| Leucoplasia oral – Factores de riesgo para la transformación maligna |
| Leucoplasia no homogénea |
| Sexo feminino |
| Leucoplasia de larga duración |
| Leucoplasia idiopática ( no asociada al tabaco, alcohol o nuez de betel) |
| Localización: borde lateral de la lengua y suelo de boca |
| Tamaño > 200 mm2 |
| Presencia de displasia epitelial |
| Presencia de Candida albicans (candidiasis hiperplásica crónica o candidiasis leucoplásica) [35] |
Tabla 3. Factores de riesgo de transformación maligna de la leucoplasia oral
Transformación maligna de la leucoplasia oral:
- Las leucoplasias con diferentes características clínicas, histológicas o moleculares pueden tener diferentes riesgos de transformarse hacia un COCE.
- Las leucoplasias no homogéneas conllevan un mayor riesgo de desarrollar un COCE en comparación con las leucoplasias homogéneas: existe un aumento de aproximadamente 7 veces el riesgo de desarrollo maligno en leucoplasias no homogéneas en comparación con las leucoplasias homogéneas y un aumento de 5 veces en el riesgo cuando el tamaño de la lesión es mayor de 200 mm2
- En las poblaciones occidentales, las mujeres de edad avanzada con leucoplasias idiopáticas de larga duración, sin factores de riesgo, paradójicamente, tienen un mayor riesgo de desarrollar un COCE, probablemente debido a un factor de riesgo endógeno más que a factores ambientales.
- El enrojecimiento en una lesión leucoplásica (leucoplasia no homogénea) indica una posible colonización por especies de Candida y también un mayor riesgo de displasia y/o malignidad.
- El grado de displasia se acepta como un fuerte predictor de futura transformación maligna de la leucoplasia oral y sigue siendo la mejor ayuda para evaluar el riesgo de desarrollo de cáncer oral.
- La leucoplasia no homogénea presenta con mayor frecuencia displasia severa o un COCE superficialmente invasivo en el momento de la biopsia inicial.
- El riesgo de desarrollar un cáncer está estrechamente relacionado con el tipo de lesión y el grado de displasia.
Diagnóstico de Leucoplasia
Es obligatorio un examen intraoral sistemático, con palpación de los ganglios linfáticos cervicales. Como se describió anteriormente, el término leucoplasia es un diagnóstico clínico que excluye otras alteraciones blancas o blanco/rojas clínicamente reconocibles. Se deben considerar los siguientes criterios al hacer un diagnóstico clínico de leucoplasia oral:
- Placa/parche blanco que no se desprende al raspado
- La leucoplasia homogénea suele tener bordes bien delimitados
- La leucoplasia no homogénea a menudo presenta componentes rojos o nodulares y bordes más difusos
- Sin evidencia de irritación traumática crónica relacionada
- No desaparece al retraer los tejidos
- No desaparece al retraer los tejidos
- Exclusión de otros trastornos blancos o blanco/rojos
Carrard y van der Waal propusieron recientemente una lista de parámetros, algunos de los cuales se describen en la tabla de abajo, que pueden ser relevantes al establecer un diagnóstico clínico de leucoplasia oral (Tabla 4).
| Características | Papel y relevancia durante el diagnóstico de la leucoplasia oral |
| Edad | La leucoplasia oral raramente aparece durante las 2 primeras décadas de la vida |
| Historia Médica | Importante para el diagnóstico diferencial de otras enfermedades que cursan con lesiones similares a la leucoplasia, como las manifestaciones orales de genodermatosis, sífilis e infección por VIH. |
| Hábito tabáquico de cualquier tipo | Más común en usuarios de tabaco |
| Síntomas | La mayoría de las leucoplasia orales son asintomáticas pero puede aparecer dolor, ardor o escozor |
| Inicio del trastorno | La leucoplasia oral suele desarrollarse lentamente, durante varios meses o años |
| Curso clinico | Curso clínico estable |
| Morfología | |
| Tamaño | El tamaño no es relevante para el diagnóstico clínico |
| Color | El color puede variar de un blanco homogéneo a una apariencia mixta de blanco y rojo |
| Textura | La textura puede variar de lisa a verrugosa. La ulceración puede ser indicativa de malignidad. |
| Induración | La palpación es una técnica de exploración muy importante, siendo la induración un signo de potencial malignidad. |
Tabla 4: Lista de algunas características, modificada de Carrard y van der Waal, que pueden ser útiles en el diagnóstico clínico y la evaluación de la leucoplasia oral
- El procedimiento gold standar para confirmar el diagnóstico clínico de una leucoplasia oral es la realización de una biopsia incisional representativa de la lesión y su envío para el análisis histopatológico.
- La biopsia diagnóstica es obligatoria para confirmar o refutar el diagnóstico de la leucoplasia oral. La biopsia y el posterior examen histopatológico permiten excluir otras patologías que pueden presentarse como una mancha blanca y evaluar la colonización por cándida dentro del epitelio.
- La biopsia es necesaria para excluir el diagnóstico de un carcinoma oral de células escamosas (COCE) y para evaluar la presencia y el grado de displasia epitelial.
- Los hallazgos histopatológicos asociados con la leucoplasia oral pueden variar desde la hiperplasia epitelial simple con hiperparaqueratosis o hiper(orto)queratosis hasta la presencia de displasia epitelial de distinto grado.
Aunque se ha propuesto una clasificación binaria para la displasia oral (grado bajo y alto), el sistema de tres grados (leve, moderado o severo) todavía se usa ampliamente en la práctica clínica en todo el mundo.
Diagnóstico Diferencial de Manchas Blancas
Durante el examen clínico de una lesión blanca, es importante evaluar cualquier posible causa traumática local y, si se identifica, la mancha blanca debe designarse como una queratosis friccional. La queratosis friccional no se considera un TOPM y al eliminar la supuesta causa traumática debería resolverse.
En la siguiente tabla se muestra una lista detallada de las lesiones y trastornos blancos más relevantes que deben ser excluidos antes de realizar un diagnóstico clínico de leucoplasia oral (Tabla 5).
| Diagnóstico diferencial de la leucoplasia oral | Descripción |
| Nevo blanco esponjoso | Observado en edades tempranas, a menudo con antecedentes familiares, presentación bilateral, largas areas involucradas, puede afectar la mucosa genital. |
| Línea alba | El diagnóstico es clínico, casi siempre bilateral a lo largo del plano de oclusión. |
| Leucoedema | Diagnóstico clínico de aspecto de velo bilateral en la mucosa yugal, y desaparece al estirar los tejidos. Predilección entre algunos grupos raciales: personas de piel oscura de mediana edad. |
| Gránulos de Fordyce | Manchas/pápulas de 1-2 mm de diámetro, elevadas, circulares, de color blanco o amarillo-blanco, claramente delimitadas de la mucosa de revestimiento circundante normal. |
| Mucosa mordisqueada (Morsicatio buccarum) | Una condición caracterizada por una irritación o lesión crónica de la mucosa bucal, las comisuras o las mejillas, causada por masticar o morder de forma habitual y repetitiva. Se observan escamas irregulares de color blanquecino-amarillento con borde dentado, a menudo bilateral. |
| Queratosis friccional | Antecedentes de trauma mecánico o fricción. La mayoría reversible tras eliminar la causa. |
| Lesiones queratósicas | Incluyen: queratosis por fumar invertido, queratosis alveolar, queratosis friccional, queratosis asociada a sanguinaria, queratosis en por tabaco sin humo y queratosis de significado desconocido. La queratosis por fumar invertido y la queratosis por tabaco sin humo tienen potencial maligno. |
| Daño químico | Antecedentes de exposición prolongada a un agente químico (ej. comprimido de aspirina) o a un agente cáustico (ej. hipoclorito de sodio). La lesión es dolorosa, pero por lo general se resuelve rápidamente. |
| Estomatitis nicotina (Palatitis nicotínica) | Paladar blanco-grisáceo con puntos rojos relacionadas con glándulas salivales menores inflamadas. Por lo general, un diagnóstico clínico asociado con antecedentes de tabaquismo. |
| Estomatitis urémica | Placas blancas, bien delimitadas, con exudado fibrinoso con algunas células epiteliales descamadas. El diagnóstico se asocia con antecedentes de enfermedad renal. |
| Queilitis actínica | El labio inferior es la localización más afectada. La presentación clínica típica puede variar y pueden ocurrir cambios similares a la leucoplasia. |
| Liquen plano oral (LPO) | En las formas típicas, las pápulas blancas se unen con líneas para formar una apariencia reticular en la superficie de la mucosa oral con inflamación variable. A menudo presentación bilateral. El LPO también puede presentarse como gingivitis descamativa. Pueden ocurrir varios subtipos clínicos de liquen plano: Reticular: líneas blancas en forma de encaje Lineal, anular, papular: varias presentaciones como líneas, en forma de anillo o puntos blancos Tipo placa: parche blanco con estrías en los márgenes Atrófico y ulceroso: rojo y francamente ulcerado Bulloso: El tipo vesicular puede ser muy difícil de distinguir de la leucoplasia oral. El LPO se incluye en el grupo de trastornos orales potencialmente malignos |
| Lesiones liquenoides orales por contacto | Causado por el contacto directo prolongado entre la mucosa oral y una amalgama u otro tipo de restauración dental. La lesión debería desaparecer en un período elegido arbitrariamente de 2 a 3 meses después de retirar la restauración. |
| Candidiasis pseudomembranosa aguda | Infección fúngica generalmente generalizada de la mucosa oral y, a veces, orofaríngea. La membrana blanca se desprende al raspado revelando un área eritematosa/en carne viva. Asociado con causas subyacentes locales (ej. esteroides en aerosol inhalados) o sistémicas (ej. inmunodeficiencia) |
| Candidiasis hiperplásica crónica | Una mancha blanca o blanca y roja causada por una infección fúngica crónica, generalmente Candida albicans. Localizada principalmente en el área de las retrocomisuras, a con frecuencia bilateral. El tratamiento antifúngico se utiliza para evaluar la regresión de las lesiones y establecer el diagnóstico. |
| Leucoplasia vellosa | Mancha queratósica con estrías verticales, causada por el virus Epstein Bar, frecuentemente bilateral y más común en los bordes laterales de la lengua. Antecedentes de inmunosupresión por enfermedad del VIH o medicamentos (ej. después de un trasplante de órganos, esteroides a largo plazo…). |
| Sífilis (secundaria) | El diagnóstico debe evaluar la historia clínica y demostrar serología positiva para el Treponema Pallidum. La presentación clínica puede ser variada: múltiples «placas mucosas», cambios blanquecinos liquenoides y leucoplásicos en la mucosa oral, múltiples lesiones rojas en el dorso de la lengua y el paladar |
| Papiloma y lesiones relacionadas con el VPH (ej. condiloma acuminado, hiperplasia epitelial multifocal, verruga vulgar) | El diagnóstico se basa en el aspecto clínico de las lesiones y en la historia clínica. Una biopsia, asociada con la tipificación del VPH, suele ser útil |
Tabla 5: Lista detallada de las principales lesiones blancas, condiciones o enfermedades que deben ser excluidas antes de hacer un diagnóstico clínico de leucoplasia oral (modificado de)
Manejo
El objetivo principal en el manejo de la leucoplasia oral debe ser monitorear y prevenir la aparición del cáncer oral. En un intento compartido por reducir las posibilidades de desarrollo de un cáncer, se han propuesto varios tratamientos y protocolos de manejo diferentes. Los principales enfoques en el manejo de la leucoplasia oral se pueden dividir en tres grupos:
- Tratamiento médico (tópico o sistémico)
- Observación clínica (tratamiento expectante); sin intervención pero con estricta vigilancia clínica e histológica)
- Cirugía: realizada con diferentes técnicas [bisturí en frío, cirugía láser (escisión y vaporización), y criocirugía
No hay consenso sobre el abordaje más adecuado para la leucoplasia oral
Tratamiento médico
Ninguno de los tratamientos médicos y complementarios estudiados (vitamina A, betacaroteno, bleomicina) ha demostrado ser eficaz para prevenir la aparición de cáncer en individuos con leucoplasia oral. Varios estudios sobre quimioprevención también han mostrado una toxicidad considerable de los fármacos utilizados. El tratamiento médico de la leucoplasia puede ser efectivo para reducir o resolver la leucoplasia oral a corto plazo, pero se ha asociado con un alto riesgo de recidivas. El uso de métodos quimiopreventivos en ensayos clínicos controlados aún no ha demostrado su eficacia en la prevención de la transformación maligna y de las recidivas.
Wait and see (Leave and Review) approach
Otro enfoque puede ser mantener una leucoplasia bajo estricta vigilancia clínica e histológica, con visitas frecuentes (exploración clínica) y biopsias oportunistas con el objetivo de detectar la transformación maligna lo antes posible, proporcionando así el mejor pronóstico posible. Este enfoque se basa en el concepto de «cancerización de campo», propuesto por Slaughter en 1957, según el cual, si un carcinógeno ha provocado un cambio premaligno o maligno clínicamente detectable en una parte de la cavidad oral, existe el mismo riesgo de malignización para otras partes de la cavidad oral debido a un efecto de cancerización de campo. La leucoplasia oral puede considerarse un indicador de riesgo para toda la mucosa oral más que para un área específica. Un ensayo clínico aleatorizado (ECA) reciente evaluó la efectividad de la escisión quirúrgica en comparación con el tratamiento expectante (seguimiento clínico regular) en la prevención del COCE en 260 sujetos con leucoplasia oral sin displasia. Dos pacientes, uno en cada brazo, desarrollaron un COCE y los autores concluyeron que el seguimiento clínico regular podría considerarse un estándar de atención confiable entre los pacientes con leucoplasia oral sin displasia.
Cirugía
Existe solamente un ensayo clínico aleatorizado (ECA) que comparó el efecto de la escisión quirúrgica versus ningún tratamiento o placebo. A pesar de ello, los tratamientos quirúrgicos son, para la mayoría de los clínicos, el tratamiento de elección en el manejo de la leucoplasia oral. La escisión quirúrgica se realiza con frecuencia y existen evidencias que sugieren que reduce el riesgo de transformación maligna en comparación con la vigilancia activa. Solamente los datos de los estudios observacionales compararon las tasas de incidencia de cáncer en personas que recibieron o no tratamiento quirúrgico para las leucoplasias orales con diferencias en los criterios de diagnóstico e inclusión, los intervalos de seguimiento, las características de los participantes y las técnicas quirúrgicas empleadas. Estos estudios mostraron resultados muy variables y fueron contradictorios en sus conclusiones.
La intervención quirúrgica con escisión con en bisturí frío y/o láser de CO2 generalmente se realiza para la leucoplasia no homogénea o la eritroplasia que se asocian con displasia de moderada a severa.
Conclusión
La cirugía sigue siendo la opción de tratamiento preferida por la mayoría de los clínicos, sin embargo, la efectividad de la cirugía en comparación con la observación clínica regular no se ha evaluado en ensayos clínicos aleatorios (ECA) para la prevención del desarrollo del cáncer en pacientes con leucoplasias orales. Hasta la fecha, solo un ECA comparó los tratamientos quirúrgicos con ningún tratamiento. En ausencia de ECA sólidos, la práctica clínica continúa variando
Referencias y Lecturas Adicionales
Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
van der Waal, I. Oral leukoplakia, the ongoing discussion on definition and terminology. Med. Oral Patol. Oral Cir. Bucal 2015, 20, e685–e692, doi:10.4317/medoral.21007.
Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; Macdonald, L.C.I.; Worthington, H. V. Interventions for treating oral leukoplakia to prevent oral cancer. Cochrane Database Syst. Rev. 2016.
Amagasa, T.; Yamashiro, M.; Uzawa, N. Oral premalignant lesions: From a clinical perspective. Int. J. Clin. Oncol. 2011, 16, 5–14, doi:10.1007/s10147-010-0157-3.
Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental
Speight, P.M.; Khurram, S.A.; Kujan, O. Oral potentially malignant disorders: risk of progression to malignancy. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018.
Napier, S.S.; Speight, P.M. Natural history of potentially malignant oral lesions and conditions: An overview of the literature. J. Oral Pathol. Med. 2008, 37, 1–10.
Carrard, V.; van der Waal, I. A Clinical Diagnosis of Oral Leukoplakia . Med Oral Patol Oral Cir Bucal 2018.
Sundberg, J.; Korytowska, M.; Holmberg, E.; Bratel, J.; Wallström, M.; Kjellström, E.; Blomgren, J.; Kovács, A.; Öhman, J.; Sand, L.; et al. Recurrence rates after surgical removal of oral leukoplakia-A prospective longitudinal multicentre study. PLoS One 2019, 14, doi:10.1371/journal.pone.0225682.
Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003,
Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
Mello, F.W.; Miguel, A.F.P.; Dutra, K.L.; Porporatti, A.L.; Warnakulasuriya, S.; Guerra, E.N.S.; Rivero, E.R.C. Prevalence of oral potentially malignant disorders: A systematic review and
Jayasooriya, P.R.; Dayaratne, K.; Dissanayake, U.B.; Warnakulasuriya, S. Malignant transformation of oral leukoplakia: a follow-up study. Clin. Oral Investig. 2020, doi:10.1007/s00784-020-03322-4.
Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, doi:10.1016/j.oraloncology.2019.104550.
Arduino, P.; Bagan, J.; El-Naggar, A.; Carrozzo, M. Urban legends series: Oral leukoplakia. Oral Dis. 2013, 19, 642–659.
Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
Syrjänen, S.; Lodi, G.; von Bültzingslöwen, I.; Aliko, A.; Arduino, P.; Campisi, G.; Challacombe, S.; Ficarra, G.; Flaitz, C.; Zhou, H.; et al. Human papillomaviruses in oral carcinoma and oral potentially malignant disorders: A systematic review. Oral Dis. 2011, 17, 58–72, doi:10.1111/j.1601-0825.2011.01792.x.
Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2020, odi.13622, doi:10.1111/odi.13622.
Awadallah, M.; Idle, M.; Patel, K.; Kademani, D. Management update of potentially premalignant oral epithelial lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 628–636.
Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncol. 2010, 46, 423–425.
Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, doi:10.1016/0030-4220(85)90313-5.
Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760,
Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9.
Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2020, 105121, doi:10.1016/j.oraloncology.2020.105121.
Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
Lombardi, N.; Sorrentino, D.; D’amore, F.; Moneghini, L.; Franchini, R.; Sardella, A. Oral erythroleukoplakia on the lateral border of the tongue in a young patient. Dent. Cadmos 2020, 88, 277–278, doi:10.19256/d.cadmos.05.2020.03.
Warnakulasuriya, S.; Ariyawardana, A. Malignant transformation of oral leukoplakia: A systematic review of observational studies. J. Oral Pathol. Med. 2016, 45, 155–166, doi:10.1111/jop.12339.
Ho, M.W.; Risk, J.M.; Woolgar, J.A.; Field, E.A.; Field, J.K.; Steele, J.C.; Rajlawat, B.P.; Triantafyllou, A.; Rogers, S.N.; Lowe, D.; et al. The clinical determinants of malignant transformation in oral epithelial dysplasia. Oral Oncol. 2012, 48, 969–976, doi:10.1016/j.oraloncology.2012.04.002.
Field, E.A.; McCarthy, C.E.; Ho, M.W.; Rajlawat, B.P.; Holt, D.; Rogers, S.N.; Triantafyllou, A.; Field, J.K.; Shaw, R.J. The management of oral epithelial dysplasia: The Liverpool algorithm. Oral Oncol. 2015, 51, 883–887.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncol. 2009.
Diz P, Gorsky M, Johnson NW, Kragelund C, Manfredi M, Odell E, et al. Oral leukoplakia and erythroplakia: a protocol for diagnosis and management. EAOM – Diagnostic Ther. Protoc. 2011, 1, 1-8.
Van der Waal, I.; Axéll, T. Oral leukoplakia: A proposal for uniform reporting. Oral Oncol. 2002, 38, 521–526.
Reddi, S.P.; Shafer, A.T. Oral Premalignant Lesions: Management Considerations. Oral Maxillofac. Surg. Clin. North Am. 2006, 18, 425–433.
Pereira, J.D.S.; Carvalho, M.D.V.; Henriques, Á.C.G.; De Queiroz Camara, T.H.; Miguel, M.C.D.C.; Freitas, R.D.A. Epidemiology and correlation of the clinicopathological features in oral epithelial dysplasia: Analysis of 173 cases. Ann. Diagn. Pathol. 2011, 15, 98–102, doi:10.1016/j.anndiagpath.2010.08.008.
Rock, L.D.; Rosin, M.P.; Zhang, L.; Chan, B.; Shariati, B.; Laronde, D.M. Characterization of epithelial oral dysplasia in non-smokers: First steps towards precision medicine. Oral Oncol. 2018, 78, 119–125, doi:10.1016/j.oraloncology.2018.01.028.
Dilhari, A.; Weerasekera, M.M.; Siriwardhana, A.; Maheshika, O.; Gunasekara, C.; Karunathilaka, S.; Nagahawatte, A.; Fernando, N. Candida infection in oral leukoplakia: an unperceived public health problem. Acta Odontol. Scand. 2016, 74, 565–569, doi:10.1080/00016357.2016.1220018.
Speight, P.M. Update on oral epithelial dysplasia and progression to cancer. Head Neck Pathol. 2007, 1, 61–66, doi:10.1007/s12105-007-0014-5.
Warnakulasuriya, S.; Kovacevic, T.; Madden, P.; Coupland, V.H.; Sperandio, M.; Odell, E.; Møller, H. Factors predicting malignant transformation in oral potentially malignant disorders among patients accrued over a 10-year period in South East England. J. Oral Pathol. Med. 2011, 40, 677–683, doi:10.1111/j.1600-0714.2011.01054.x.
Arduino, P.G.; Surace, A.; Carbone, M.; Elia, A.; Massolini, G.; Gandolfo, S.; Broccoletti, R. Outcome of oral dysplasia: A retrospective hospital-based study of 207 patients with a long follow-up. J. Oral Pathol. Med. 2009, 38, 540–544, doi:10.1111/j.1600-0714.2009.00782.x.
Watabe, Y.; Nomura, T.; Onda, T.; Yakushiji, T.; Yamamoto, N.; Ohata, H.; Takano, N.; Shibahara, T. Malignant transformation of oral leukoplakia with a focus on low-grade dysplasia. J. Oral Maxillofac. Surgery, Med. Pathol. 2016, 28, 26–29, doi:10.1016/j.ajoms.2015.02.007.
Kujan, O.; Oliver, R.J.; Khattab, A.; Roberts, S.A.; Thakker, N.; Sloan, P. Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol. 2006, doi:10.1016/j.oraloncology.2005.12.014.
El-Naggar A.K., Chan J.K.C., Grandis J.R., Takata T., S.P.J. WHO classification of Head and Neck tumors; 4th ed.; IARC Press: Lyon, 2017; ISBN 9789283224372.
Thomson, P. Oral Precancer; Thomson, P., Ed.; John Wiley & Sons, Ltd.: West Sussex, UK, 2012; ISBN 9781118702840.
Warnakulasuriya, S.; Reibel, J.; Bouquot, J.; Dabelsteen, E. Oral epithelial dysplasia classification systems: Predictive value, utility, weaknesses and scope for improvement. J. Oral Pathol. Med. 2008, 37, 127–133.
Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chen, Y.J.; Chiang, C.P.; Liu, B.Y.; Jeng, J.H.; Chang, H.H.; Kuo, Y.S.; Lan, W.H.; et al. Carcinoma and dysplasia in oral leukoplakias in Taiwan: Prevalence and risk factors. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2006, 101, 472–480, doi:10.1016/j.tripleo.2005.07.024.
Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
Reibel, J.; Gale, N.; Hille, J.; Hunt, J.; Lingen, M.; Muller, S.; Sloan, P.; Tilakaratne, W.; Westra, W.; Williams, M.; et al. Oral potentially malignant disorders and oral epithelial dysplasia. In WHO classification of head and neck tumours; IARC, Ed.; Lyon France, 2017; pp. 112–115 ISBN 9789283224389.
Ranganathan, K.; Kavitha, L. Oral epithelial dysplasia: Classifications and clinical relevance in risk assessment of oral potentially malignant disorders. J. Oral Maxillofac. Pathol. 2019, 23, 19–27.
Barnes, L.; Eveson, J.W.; Reichart, P.; Sidransky, D. World Health Organization Classification of Tumours. Pathology & Genetics. Head and Neck Tumours. International Agency for Research on Cancer (IARC). WHO Classif. Tumours (3rd Ed. 2005, 177–80.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
Meleti, M.; Giovannacci, I.; Vescovi, P.; Pedrazzi, G.; Govoni, P.; Magnoni, C. Histopathological determinants of autofluorescence patterns in oral carcinoma. Oral Dis. 2020, doi:10.1111/odi.13304.
Tiwari, L.; Kujan, O.; Farah, C.S. Optical fluorescence imaging in oral cancer and potentially malignant disorders: A systematic review. Oral Dis. 2020.
Warnakulasuriya, S. White, red, and mixed lesions of oral mucosa: A clinicopathologic approach to diagnosis. Periodontol. 2000 2019, 80, 89–104.
Auluck, A.; Pai, K.M. (Mis)interpretations of leukoplakia. J. Can. Dent. Assoc. (Tor). 2005.
Müller, S. Frictional Keratosis, Contact Keratosis and Smokeless Tobacco Keratosis: Features of Reactive White Lesions of the Oral Mucosa. Head Neck Pathol. 2019, 13, 16–24.
Kramer, I.R.; El, L.; Lee, K.W. The clinical features and risk of malignant transformation in sublingual keratosis. Br. Dent. J. 1978, 144, 171–180, doi:10.1038/sj.bdj.4804055.
Eversole, L.R.; Eversole, G.M.; Kopcik, J. Sanguinaria-associated oral leukoplakia: Comparison with other benign and dysplastic leukoplakic lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2000, 89, 455–464, doi:10.1016/S1079-2104(00)70125-9.
Gupta, P.C.; Mehta, F.S.; Daftary, D.K. Incidence rates of oral cancer and natural history of oral precancerous lesions in a 10-year follow-up study of Indian villagers. Community Dent. Oral Epidemiol. 1980, 8, 287–333, doi:10.1111/j.1600-0528.1980.tb01302.x.
Sreenivasa Bharath, T.; Govind Raj Kumar, N.; Nagaraja, A.; Saraswathi, T.R.; Suresh Babu, G.; Ramanjaneya Raju, P. Palatal changes of reverse smokers in a rural coastal Andhra population with review of literature. J. Oral Maxillofac. Pathol. 2015, 19, 182–187, doi:10.4103/0973-029X.164530.
Woo, S. Bin; Grammer, R.L.; Lerman, M.A. Keratosis of unknown significance and leukoplakia: A preliminary study. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2014, 118, 713–724, doi:10.1016/j.oooo.2014.09.016.
Villa, A.; Hanna, G.J.; Kacew, A.; Frustino, J.; Hammerman, P.S.; Woo, S. Bin Oral keratosis of unknown significance shares genomic overlap with oral dysplasia. Oral Dis. 2019, 25, 1707–1714, doi:10.1111/odi.13155.
Lodi, G.; Porter, S. Management of potentially malignant disorders: Evidence and critique. J. Oral Pathol. Med. 2008, 37, 63–69.
Kanatas, A.N.; Fisher, S.E.; Lowe, D.; Ong, T.K.; Mitchell, D.A.; Rogers, S.N. The configuration of clinics and the use of biopsy and photography in oral premalignancy: A survey of consultants of the British Association of Oral and Maxillofacial Surgeons. Br. J. Oral Maxillofac. Surg. 2011, 49, 99–105, doi:10.1016/j.bjoms.2010.01.016.
Kumar, A.; Cascarini, L.; McCaul, J.A.; Kerawala, C.J.; Coombes, D.; Godden, D.; Brennan, P.A. How should we manage oral leukoplakia? Br. J. Oral Maxillofac. Surg. 2013, 51, 377–383, doi:10.1016/j.bjoms.2012.10.018.
Dionne, K.R.; Warnakulasuriya, S.; Zain, R.B.; Cheong, S.C. Potentially malignant disorders of the oral cavity: Current practice and future directions in the clinic and laboratory. Int. J. Cancer 2015, 136, 503–515.
Diajil, A.; Robinson, C.M.; Sloan, P.; Thomson, P.J. Clinical Outcome Following Oral Potentially Malignant Disorder Treatment: A 100 Patient Cohort Study. Int. J. Dent. 2013, 2013, 1–8, doi:10.1155/2013/809248.
Ribeiro, A.S.; Salles, P.R.; da Silva, T.A.; Mesquita, R.A. A Review of the Nonsurgical Treatment of Oral Leukoplakia. Int. J. Dent. 2010, 2010, 1–10, doi:10.1155/2010/186018.
Jaiswal, G.; Jaiswal, S.; Kumar, R.; Sharma, A. Field cancerization: concept and clinical implications in head and neck squamous cell carcinoma. J. Exp. Ther. Oncol. 2013.
Arduino, P.G.; Lodi, G.; Cabras, M.; Macciotta, A.; Gambino, A.; Conrotto, D.; Karimi, D.; El Haddad, G.; Carbone, M.; Broccoletti, R. A Randomized Controlled Trial on Efficacy of Surgical Excision of non-dysplastic Leukoplakia to Prevent Oral Cancer. Cancer Prev. Res. 2020, canprevres.0234.2020, doi:10.1158/1940-6207.capr-20-0234.
Mehanna, H.M.; Rattay, T.; Smith, J.; McConkey, C.C. Treatment and follow-up of oral dysplasia – A systematic review and meta-analysis. Head Neck 2009, doi:10.1002/hed.21131.
Saito, T.; Sugiura, C.; Hirai, A.; Notani, K.I.; Totsuka, Y.; Shindoh, M.; Fukuda, H. Development of squamous cell carcinoma from pre-existent oral leukoplakia: With respect to treatment modality. Int. J. Oral Maxillofac. Surg. 2001, 30, 49–53.
Zhang, L.; Lubpairee, T.; Laronde, D.M.; Rosin, M.P. Should severe epithelial dysplasia be treated? Oral Oncol. 2016, 60, 125–129, doi:10.1016/j.oraloncology.2016.07.007.
Balasundaram, I.; Payne, K.F.B.; Al-Hadad, I.; Alibhai, M.; Thomas, S.; Bhandari, R. Is there any benefit in surgery for potentially malignant disorders of the oral cavity? J. Oral Pathol. Med. 2014.
Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.
Kuribayashi, Y.; Tsushima, F.; Morita, K.; Matsumoto, K.; Sakurai, J.; Uesugi, A.; Sato, K.; Oda, S.; Sakamoto, K.; Harada, H. Long-term outcome of non-surgical treatment in patients with oral leukoplakia. Oral Oncol. 2015, 51, 1020–1025, doi:10.1016/j.oraloncology.2015.09.004.
Mogedas-Vegara, A.; Hueto-Madrid, J.A.; Chimenos-Küstner, E.; Bescós-Atín, C. Oral leukoplakia treatment with the carbon dioxide laser: A systematic review of the literature. J. Cranio-Maxillofacial Surg. 2016, doi:10.1016/j.jcms.2016.01.026.







