Leucoplasie
Plusieurs définitions ont été proposées pour la leucoplasie orale (LO) et celle-ci n’a cessé d’évoluer au cours des 40 dernières années (tableau 1). La définition la plus récente et la plus largement acceptée a été proposée par l’OMS en 2007 et reconfirmée en 2020. La leucoplasie est définie comme « une plaque à prédominance blanche dont le risque est discutable, après l’exclusion des (autres) maladies ou troubles connus qui ne comportent pas de risque accru de cancer ».
Le terme de leucoplasie est utilisé lorsque toute autre affection de la muqueuse buccale pouvant se présenter sous la forme d’une lésion blanche a été exclue (par exemple, kératose frictionnelle, lichen plan, nævus spongieux blanc, leucoplasie verruqueuse, etc.) Par définition, la leucoplasie est une entité clinique, dont le diagnostic est un diagnostic d’exclusion et elle n’a pas de composante histopathologique spécifique.
Epidemiologie et facteurs de risque des leucoplasies orales
Epidemiologie:
- Communément diagnostiqué chez les patients d’âge moyen à avancé.
- Le plus souvent retrouvé chez l’homme
- La LO est six fois plus fréquente chez les fumeurs que chez les non-fumeurs.
- La prévalence de la LO varie considérablement selon les régions géographiques en raison de différents facteurs de risque, comme la mastication de la noix de bétel en Asie du Sud-Est.
Facteurs de risque:
- La LO est associée à divers facteurs de risque, similaires à ceux observés dans le cancer de la bouche, tels que le tabac (fumé ou non), la consommation importante d’alcool, la mastication de chique de bétel (notamment dans les pays d’Asie du Sud) et, pour les lésions touchant la lèvre, l’exposition aux rayons ultraviolets (UV).
- La consommation d’alcool est un facteur de risque indépendant. Il a été établi que ces facteurs peuvent avoir un rôle étiologique dans le développement de la LO chez plus de 75% des personnes atteintes.
Manifestation clinique
- Les LO peuvent apparaître n’importe où dans la cavité buccale et peuvent être uni- ou multifocales. Cependant, dans les populations occidentales industrialisées, les localisations les plus fréquentes sont le bord latéral de la langue et le plancher de la bouche.
- Dans les populations asiatiques, en raison de la consommation fréquente de chique de bétel, la muqueuse vestibulaire et la muqueuse labiale sont souvent touchées.
- Sur le plan clinique, les leucoplasies présentent un large éventail de caractéristiques variables en termes d’aspect (blanc, rouge et mixte blanc et rouge, plaque/plateau granulaire, atrophique), de texture (lisse, ondulée, granulaire verruqueuse, molle, ferme ou dure), de taille et de forme.
- L’extension clinique de la leucoplasie buccale peut varier en taille, allant d’une lésion relativement petite et bien circonscrite à une lésion étendue touchant une grande surface de la muqueuse buccale.
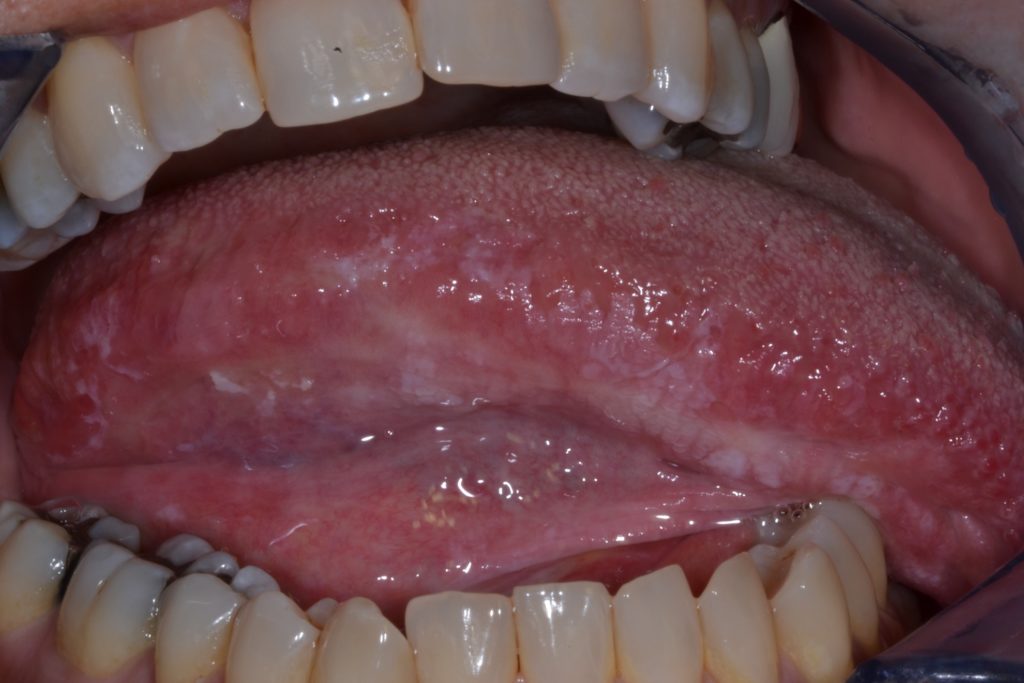
La leucoplasie peut être cliniquement classée en deux sous-types : homogène et non-homogène. Figures 1 et 2.
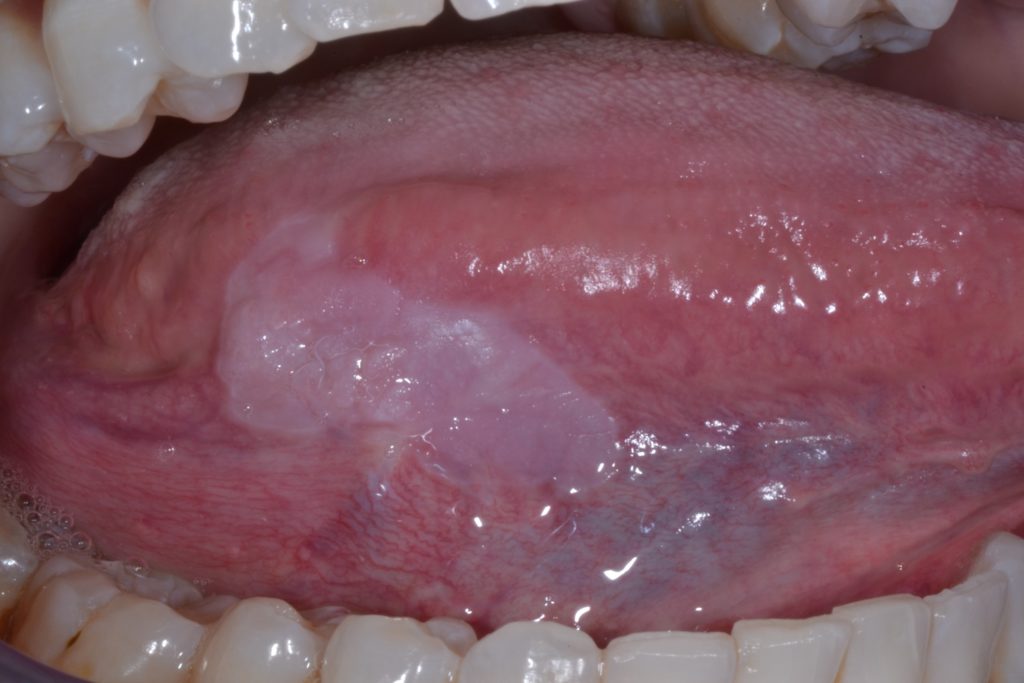
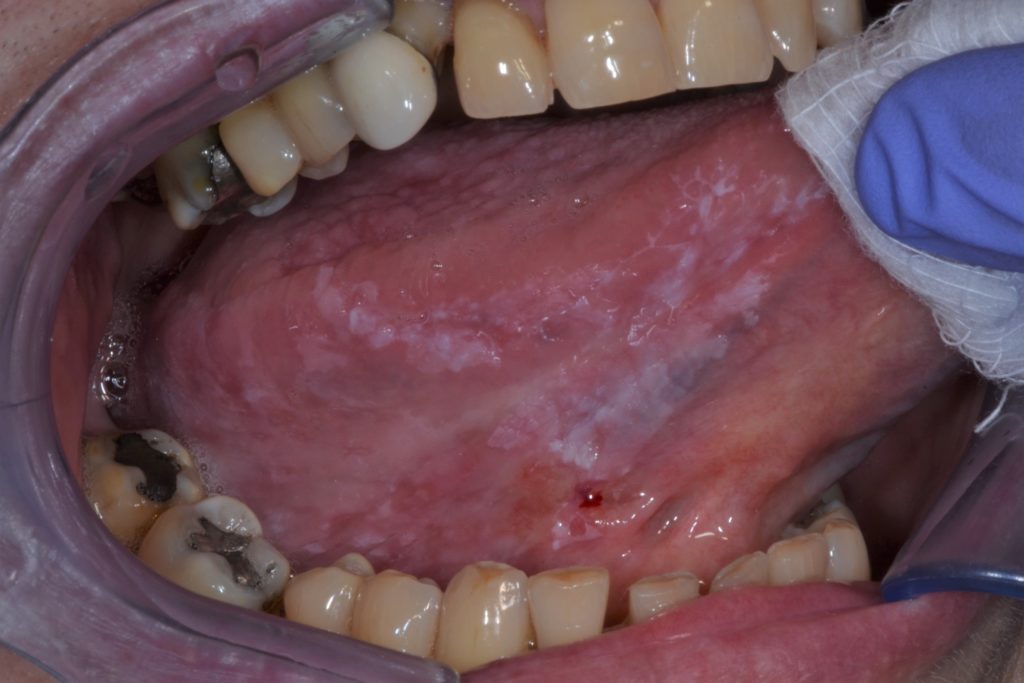
Cette distinction est purement clinique et repose sur des caractéristiques distinctes telles que la surface, la couleur et la texture : leucoplasie homogène et leucoplasie non homogène (tableau 2).
| Leucoplasie Orale | |
| Leucoplasie homogène | Leucoplasie inhomogène |
| Plaque/patch blanc uniforme et fin avec des marges bien définies, une surface lisse associée à des fissures/fissures peu profondes. Ne peut être détaché au grattage. | Speckled: Aspect mixte blanc et rouge Nodular: Petites excroissances polypoïdes, arrondies, rouges ou blanches Verruqueux ou exophytique: surface rugueuse ou ondulée qui ne peut pas être détachée au grattage. |
Tableau 2: Classification de la leucoplasie orale en fonction dee son aspect clinique
Leucoplasie Homogène :
- Caractérisée par une plaque/patch blanc(he) uniforme, plate et fine, aux bords bien définis et à la surface lisse, pouvant être associée à des craquelures/fissures peu profondes de la kératine de surface. Illustré plus en détail dans la figure 3.
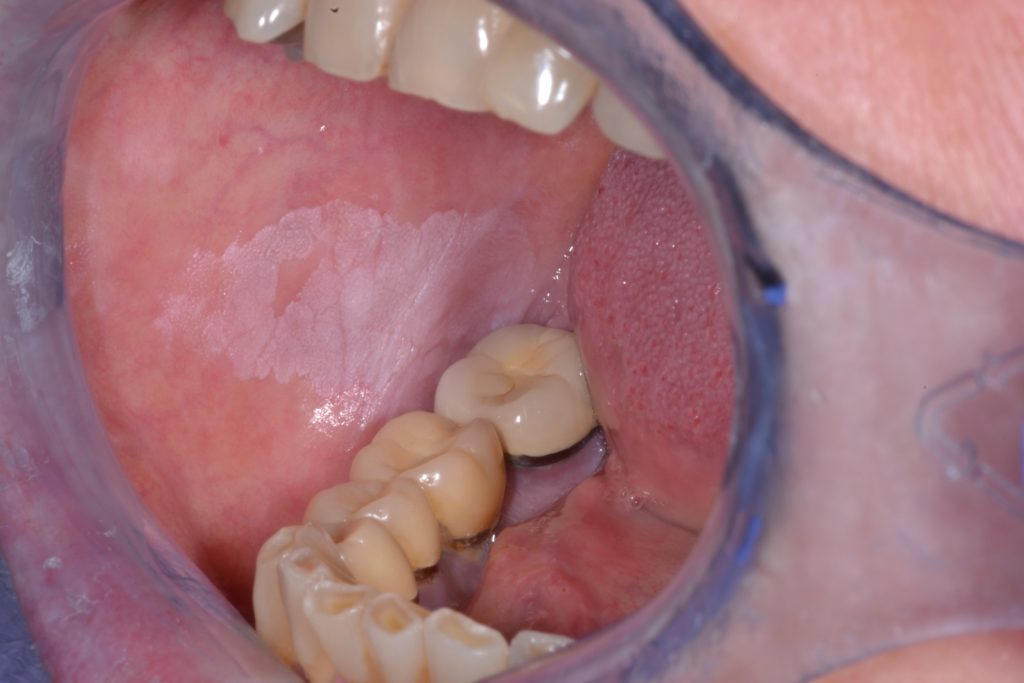
Leukoplasie non-homogène:
- Caractérisée par une texture irrégulière, qui peut inclure une ulcération superficielle focale, et des marges mal définies. Les leucoplasies non homogènes peuvent être associées à différentes manifestations cliniques utilisées pour leur description : Illustré plus en détail dans les figures 4 et 5.
- Aspect moucheté : couleur mixte blanche et rouge mais conservant une coloration blanche prédominante (également défini comme érythroleucoplasie)
- Nodulaire : petites projections polypoïdes, excroissances arrondies, rouges ou blanches.
- Verruqueux ou exophytique : aspect de surface ridé ou rugueux.
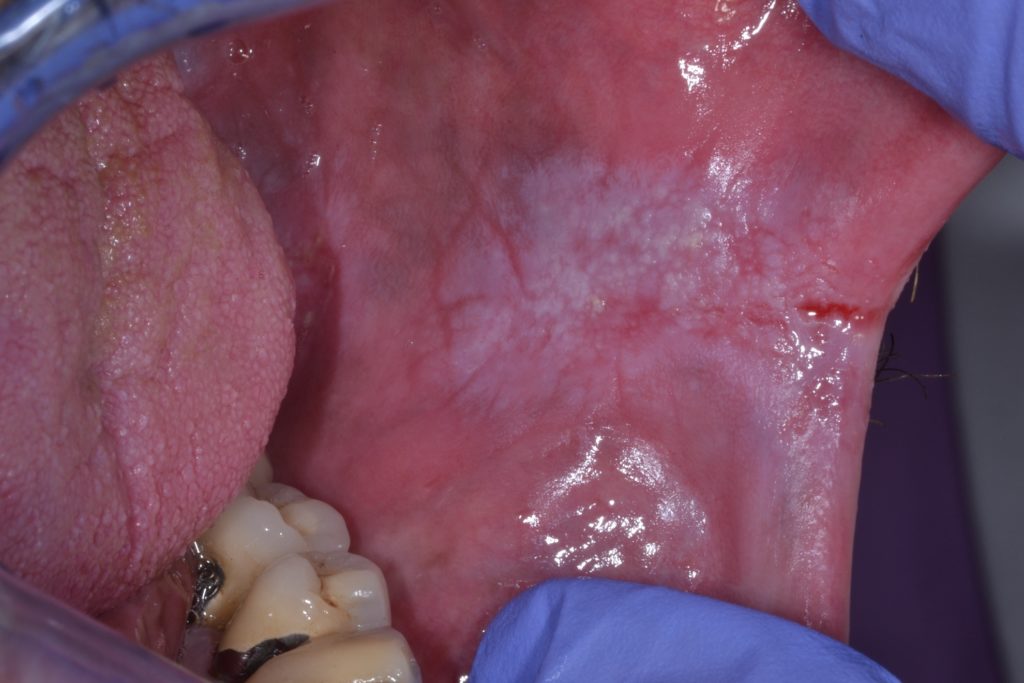
- Les leucoplasies sont généralement asymptomatiques et sont souvent identifiées lors d’un examen général de routine.
- Les leucoplasies homogènes sont généralement asymptomatiques.
- Les symptômes sont rares, et s’ils sont présents, ils sont généralement associés aux formes non homogènes qui peuvent présenter une ulcération superficielle focale.
- Les symptômes les plus fréquemment rapportés sont une gêne, des picotements et une sensibilité au toucher, aux boissons chaudes ou aux aliments épicés.
Risque de survenue de cancer
Carcinome épidermoïde oral:
- Le carcinome épidermoïde oral (CEO) est la néoplasie la plus fréquente de la cavité buccale.
- Le CEO touche généralement les hommes de plus de 60 ans, mais sa prévalence a récemment augmenté chez les jeunes de moins de 40 ans.
- Le CEO peut se présenter sous la forme d’une ulcération qui ne cicatrise pas, d’une masse croissante à la surface irrégulière et de lésions rouges ou blanches de l’épithélium buccal.
Leucoplasie:
- Les leucoplasies sont classées parmi les affections buccales à potentiel malin qui prédisposent les personnes touchées à un risque accru de développement d’un carcinome épidermoïde oral.
- La LO montre des pourcentages variables de progression vers le CEO, variant de 0 à 36,4 %. Le taux annuel de transformation varie de 0,3 % à 6,9 % par an, comme le rapporte une récente revue d’études observationnelles.
- Les facteurs de risque, qui ont montré une association significativement statistique, pour le développement du cancer chez les personnes touchées par la LO sont énumérés dans le tableau 4.
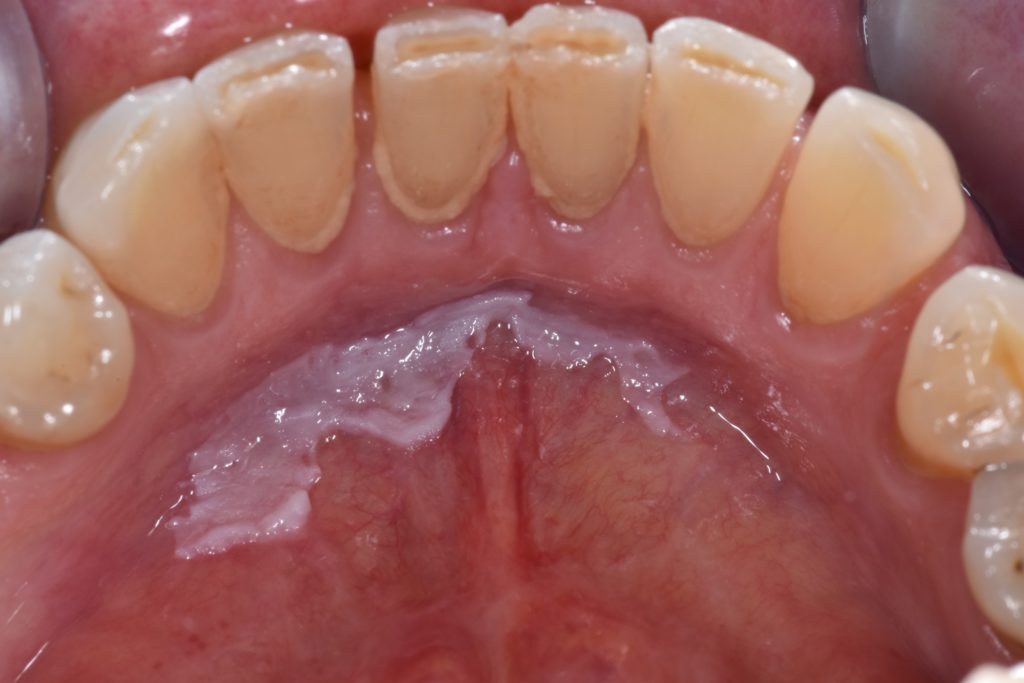
- La figure 6 illustre une leucoplasie du plancher buccal, considéré comme une localisation à haut risque en raison du regroupement des agents cancérigènes.
| Leucoplasie orale – Facteurs de risque de transformation maligne |
| Aspect clinique non homogène |
| Sexe féminin |
| Leucoplasie ancienne |
| Leucoplasie idiopathique (statut non-fumeur/non-buveur/non-mâcheur) |
| Localisation : bord latéral de langue et/ou plancher de la bouche |
| Size > 200 mm2 |
| Présence d’une dysplasie épithéliale |
| Présence de Candida albicans (candidose hyperplasique chronique ou leucoplasie à candida) [35]. |
Tableau 3. Facteurs de risque de transformation maligne pour la leucoplasie orale
Transformation d’une leucoplasie en CEO:
- Les leucoplasies présentant des caractéristiques cliniques, histologiques ou moléculaires différentes peuvent avoir des risques différents de se transformer en CEO.
- Les leucoplasies non homogènes comportent un risque plus élevé de développement de CEO que les leucoplasies homogènes – le risque de transformation maligne est environ 7 fois plus élevé dans le cas d’une leucoplasie non homogène que dans celui d’une leucoplasie homogène et 5 fois plus élevé lorsque la taille de la lésion est supérieure à 200 mm2.
- Dans les populations occidentales, les femmes âgées présentant une leucoplasie idiopathique de longue date, sans facteur de risque, ont paradoxalement un risque accru de progression vers le cancer, probablement dû à un facteur de risque endogène plutôt qu’à des facteurs environnementaux.
- Une rougeur dans une lésion de LO (lésion non homogène) indique une colonisation potentielle par l’espèce Candida et également un risque accru de dysplasie et/ou de malignité.
- Le degré de la dysplasie est considéré comme un facteur prédictif important de la transformation maligne future de la LO et reste le meilleur moyen d’évaluer le risque de développement d’un cancer de la bouche.
- Les leucoplasies non homogènes présentent plus souvent une dysplasie sévère ou un CEO superficiellement invasif au moment de la biopsie initiale.
- Le risque de développement d’un cancer est étroitement lié au type de lésion et au grade de la dysplasie.
Diagnostic de la Leucoplasie
Un examen intra-oral systématique, avec palpation des aires ganglionnaires cervicales, est obligatoire [5]. Comme décrit ci-dessus, le terme leucoplasie est un diagnostic clinique ayant exclu d’autres lésions blanches ou blanches/rouges cliniquement reconnaissables. Les critères suivants doivent être pris en compte pour établir un diagnostic clinique de leucoplasie orale :
- une tache/plaque blanche qui ne peut être détachée au grattage
- leucoplasie homogène présentant généralement des bords bien délimités
- la leucoplasie non homogène présente souvent des composantes rouges ou nodulaires et des bords plus diffus
- aucun signe d’irritation traumatique chronique associée
- Absence de régression après élimination des causes traumatiques apparentes
- ne disparaît pas lors de la rétraction du tissu
- Exclue toute autre lésion blanche ou rouge et blanche
Carrard et van der Waal ont récemment proposé une liste de critères, dont certains sont rapportés dans le tableau, qui peuvent être pertinents pour établir un diagnostic clinique de leucoplasie orale (tableau 4).
| Caractéristiques | Rôle et pertinence lors du diagnostic clinique de la leucoplasie orale. |
| âge | La LO survient rarement dans les deux premières décennies de la vie. |
| Antécédents médicaux | Important pour le diagnostic de plusieurs maladies ressemblant à des leucoplasies, comme les manifestations buccales des génodermatoses, la syphilis et l’infection par le VIH. |
| Tabagisme, quel qu’il soit | Plus fréquente chez les consommateurs de tabac |
| Symptômes | La plupart des LO sont asymptomatiques, mais des douleurs ou des démangeaisons peuvent apparaître. |
| Début de la maladie | Les LO se développent lentement, sur plusieurs mois ou années. |
| Évolution de la maladie | L’évolution clinique est stable. |
| Morphologie | |
| Taille | La taille n’est pas un critère pertinent pour le diagnostic clinique de LO. |
| Couleur | La couleur peut varier du blanc homogène à un aspect mixte blanc et rouge. |
| Texture | La texture peut varier de lisse, fripée à verruqueuse. Une ulcération peut être un signe de malignité. |
| Induration | La palpation est un outil d’examen très important, l’induration étant un signe de lésion potentiellement maligne.. |
Tableau 4 : Liste de quelques caractéristiques, modifiée d’après Carrard et van der Waal, qui peuvent être utiles dans le diagnostic clinique et l’évaluation de la leucoplasie.
- La procédure de référence pour confirmer le diagnostic clinique de leucoplasie buccale consiste à effectuer une biopsie incisionnelle représentative de la lésion blanche et de l’envoyer pour une analyse histopathologique.
- ne biopsie diagnostique est obligatoire pour confirmer ou réfuter le diagnostic de LO. La biopsie, et l’examen histopathologique qui s’ensuit, permettent d’exclure d’autres pathologies qui peuvent se présenter sous la forme d’une tache blanche et d’évaluer la colonisation par le candida dans l’épithélium.
- La biopsie est nécessaire pour exclure le diagnostic de carcinome épidermoïde oral (CEO) et pour évaluer la présence et le degré de dysplasie épithéliale.
- Les résultats histopathologiques associés à la leucoplasie orale peuvent aller d’une simple hyperplasie épithéliale avec hyperparakératose ou hyper(ortho)kératose, à l’absence ou la présence et au degré de dysplasie épithéliale.
Bien qu’une classification binaire de la dysplasie orale (bas grade et haut grade) ait été proposée, le système à trois grades (léger, modéré ou sévère) est encore largement utilisé dans la pratique clinique à travers le monde.
Diagnostic différentiel des lésions blanches
Lors de l’examen clinique d’une lésion blanche, il est important d’évaluer toute cause traumatique locale potentielle et, si elle est identifiée, la tache blanche doit être désignée comme une kératose frictionnelle. La kératose de frottement n’est pas considérée comme une lésion à potentiel malin et, en suuprimant l’agent traumatique supposé, elle devrait disparaître.
Le tableau suivant présente une liste détaillée des lésions blanches et des troubles les plus pertinents qui doivent être exclus avant de poser un diagnostic clinique de leucoplasie orale (tableau 5).
| Dignostic différentiel avec la LO | Description |
| Naevus spongieux blanc | Constaté au début de la vie, souvent des antécédents familiaux, présentation bilatérale, souvent étendu dans la bouche, les muqueuses génitales peuvent être touchées. |
| Linea alba | Le diagnostic est clinique, presque toujours bilatéral le long du plan d’occlusion. |
| Leucoedème | Diagnostic clinique reposant sur un aspect de voile bilatéral sur la muqueuse buccale, qui disparaît en étirant les tissus. Prédilection chez certains groupes raciaux : personnes d’âge moyen à la peau foncée. |
| Grains de Fordyce | Taches/papules de 1 à 2 mm de diamètre, nettement délimitées par rapport à la muqueuse environnante normale, surélevées, circulaires, de couleur blanche ou jaune-blanc. |
| Morsicatio buccarum | Affection caractérisée par une irritation ou une lésion chronique de la muqueuse buccale, des commissures ou des joues, causée par une mastication ou une morsure habituelle et répétitive. On observe des flocons blanchâtres-jaunâtres irréguliers avec une ligne de sortie dentelée ; souvent bilatéraux. |
| keratose traumatique | On retrouve une friction ou un autre traumatisme mécanique. Le plus souvent réversible après élimination de la cause étiologique. |
| Léisions kératosiques | Il s’agit de la kératose fumeuse réversible, de la kératose de la crête alvéolaire, de la kératose frictionnelle, de la kératose associée à la sanguinaria, de la kératose de la poche à tabac et de la kératose de signification inconnue. La kératose fumeuse réversible et la kératose de la poche à tabac ont un potentiel malin. |
| Blessure chimique | Antécédents d’exposition prolongée à un agent chimique (par exemple, un comprimé d’aspirine) ou à un agent caustique (par exemple, l’hypochlorite de sodium). La lésion est douloureuse, mais elle disparaît généralement rapidement. |
| Stomatite nicotinique | Palais gris-blanc avec des taches rouges len rapport avec une inflammation des glandes salivaires accessoires. Habituellement, le diagnostic est clinique associé à des antécédents de tabagisme. |
| stomatite urémique | Plaques blanches, bien délimitées et adhérentes d’exsudat fibrineux avec quelques cellules épithéliales desquamées. Le diagnostic est associé à des antécédents positifs de maladie rénale. |
| Chéilite actinique | La lèvre inférieure est la zone la plus touchée par ces lésions blanches. La présentation clinique typique peut varier et des changements de type leucoplasie peuvent apparaître. |
| Lichen plan oral (OLP) | Dans les formes typiques, on retrouve des papules blanches associées à des lignes formant un aspect réticulaire à la surface d’une muqueuse qui peut être inflammatoire. Le plus souvent il s’agit de lésions bilatérales. Le lichen plan peut également se présenter sous forme de gingivite desquamative. Il existe plusieurs sous-types cliniques de lichen plan: réticulé: des lignes blanches en forme de dentelle, Linéaires, annulaires, papulaires : diverses présentations sous forme de lignes, d’anneaux ou de points blancs en plaque:tache blanche avec rayures sur les bords. Atrophié et ulcéré: rouge et nettement ulcéré Bulleux: Le LPO vésiculaire ou en plaque peut être très difficile à distinguer d’une leucoplasie buccale. Le LPO est inclus dans le groupe des lésions à potentiel malin de la muqueuse buccale. |
| Lésion lichénoïde de contact | Causée par un contact direct prolongé de la muqueuse buccale avec un amalgame ou d’autres types de restauration. La lésion doit disparaître dans un délai choisi arbitrairement de 2 à 3 mois après le retrait de la restauration. |
| Candidose aiguë pseudomembraneuse | Infection généralement étendue au niveau de la muqueuse buccale, et parfois oropharyngée. La membrane blanche peut être détachée au grattage, révélant parfois une empreinte érythémateuse/brutale. Associée à des causes sous-jacentes locales (par exemple, stéroïdes en spray inhalés) ou systémiques (par exemple, immunodéficience). |
| Candidose hyperplasique chronique (Leucoplasie Candidosique) | Tache blanche ou blanche et rouge adhérente causée par une infection fongique chronique, généralement Candida albicans. Principalement située dans la zone rétro-commissurale, souvent bilatérale. Un traitement antifongique est utilisé pour évaluer la régression des lésions et établir le diagnostic. |
| Leucoplasie orale chevelue | Kératose avec stries verticales, causée par le virus opportuniste d’Epstein Bar, qui est souvent bilatérale et plus fréquente sur les bords latéraux de la langue. Antécédents d’immunosuppression causée par une maladie à VIH ou d’origine médicamenteuse (par exemple, après une transplantation d’organe/stéroïdes à long terme). |
| Syphilis, secondaire | Le diagnostic doit évaluer les antécédents médicaux et démontrer la positivité de la sérologie pour Treponema Pallidum. La présentation clinique peut être variée : multiples « plaques muqueuses », modifications blanchâtres de type lichénoïde et leucoplasie de la muqueuse buccale, multiples lésions rouges sur la partie dorsale de la langue et du palais. |
| Lésions liées aux papillomes et au HPV (par exemple, condylome acuminé, hyperplasie épithéliale multifocale, verrue vulgaire). | Le diagnostic repose sur l’aspect clinique des lésions et sur les antécédents médicaux. Une biopsie, associée au typage du HPV, est généralement utile. |
Tableau 5 Liste détaillée des principales lésions blanches, affections ou maladies à exclure avant de poser un diagnostic clinique de leucoplasie orale (modifié par [1,9])
Traitement
L’objectif principal de la prise en charge de la leucoplasie buccale devrait être de surveiller et de prévenir l’apparition d’un cancer de la bouche. Dans une tentative commune de réduire les risques de développement du cancer, un certain nombre de traitements et de protocoles de gestion différents ont été proposés. Les principales approches de la prise en charge des LO peuvent être divisées en trois groupes :
- Traitement médicalmenteux (topique ou systémique)
- observation clinique: aucune intervention mais surveillance clinique et histologique stricte
- chirurgie : réalisée avec différentes techniques (bistouri, chirurgie au laser (excision et vaporisation), cryochirurgie)
Il n’y a pas de consensus sur la prise en charge de la LO.
Treatment médicamenteux
Aucun des traitements médicamenteux et complémentaires étudiés (vitamine A, bêta-carotène, bléomycine) ne s’est avéré efficace pour prévenir l’apparition du cancer chez les personnes atteintes de LO. Plusieurs études sur la chimio-prévention ont également montré une toxicité considérable des médicaments utilisés. Les traitements médicaux de la leucoplasie peuvent être efficaces pour réduire ou résoudre la leucoplasie orale à court terme, mais ils ont été associés à un risque élevé de rechute. L’utilisation de méthodes chimio-préventives dans des essais cliniques contrôlés n’a pas encore montré son efficacité dans la prévention de la transformation maligne et de la récidive ultérieure.
Surveillance
Une autre approche peut consister à maintenir une leucoplasie sous une surveillance clinique et histologique stricte, avec des visites cliniques (examens) et des biopsies fréquentes dans le but de détecter une transformation maligne le plus tôt possible, offrant ainsi le meilleur pronostic possible. Cette approche est basée sur le concept de « cancérisation de champ », proposé par Slaughter en 1957, selon lequel si un agent cancérigène a entraîné une modification prémaligne ou maligne cliniquement détectable dans une partie de la cavité buccale, il existe un risque égal pour les autres parties de la cavité buccale en raison d’un effet de champ. Le LO peut être considérée comme un indicateur de risque pour l’ensemble de la muqueuse buccale plutôt que pour une zone spécifique à un site. Un récent ECR a évalué l’efficacité de l’excision chirurgicale, comparée aux soins standard, dans la prévention du carcinome épidermoide chez 260 sujets présentant une LO non dysplasique. Deux patients, un dans chaque bras, ont développé un carcinome épidermoide et les auteurs ont conclu qu’un suivi clinique régulier pouvait être considéré comme une norme de soins fiable chez les patients atteints de LO non dysplasiques.
Chirurgie
Il existe un seul essai contrôlé randomisé (ECR) qui a comparé l’effet de l’excision chirurgicale par rapport à l’absence de traitement ou au placebo. Malgré cela, les traitements chirurgicaux constituent, pour la plupart des cliniciens, le traitement de choix dans la prise en charge des leucoplasies buccales. L’excision chirurgicale est fréquemment pratiquée et certaines données suggèrent qu’elle réduit le risque de transformation maligne par rapport à la surveillance active. Seules des données issues d’études d’observation ont permis de comparer les taux d’incidence du cancer chez les personnes ayant subi ou non un traitement chirurgical pour des leucoplasies buccales, avec des différences dans les critères de diagnostic et d’inclusion, les intervalles de suivi, les caractéristiques des participants et les techniques chirurgicales employées. Ces études ont donné des résultats très variables et leurs conclusions étaient contradictoires.
Une intervention chirurgicale par excision à la lame froide et/ou au laser CO2 est généralement pratiquée pour les leucoplasies ou érythroplasies non homogènes associées à une dysplasie modérée à sévère.
Conclusion
La chirurgie reste l’option thérapeutique privilégiée par la plupart des gens, mais l’efficacité de la chirurgie par rapport à l’observation clinique régulière n’a pas été évaluée dans des ECR pour la prévention du développement du cancer. À ce jour, un seul ECR a comparé les traitements chirurgicaux à l’absence de traitement. En l’absence d’essais cliniques randomisés solides, la pratique clinique continue de varier.
Réferences bibliographiques et lectures complémentaires
Warnakulasuriya, S.; Kujan, O.; Aguirre‐Urizar, J.M.; Bagan, J. V.; González‐Moles, M.Á.; Kerr, A.R.; Lodi, G.; Mello, F.W.; Monteiro, L.; Ogden, G.R.; et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2020, odi.13704, doi:10.1111/odi.13704.
van der Waal, I. Oral leukoplakia, the ongoing discussion on definition and terminology. Med. Oral Patol. Oral Cir. Bucal 2015, 20, e685–e692, doi:10.4317/medoral.21007.
Lodi, G.; Franchini, R.; Warnakulasuriya, S.; Varoni, E.M.; Sardella, A.; Kerr, A.R.; Carrassi, A.; Macdonald, L.C.I.; Worthington, H. V. Interventions for treating oral leukoplakia to prevent oral cancer. Cochrane Database Syst. Rev. 2016.
Amagasa, T.; Yamashiro, M.; Uzawa, N. Oral premalignant lesions: From a clinical perspective. Int. J. Clin. Oncol. 2011, 16, 5–14, doi:10.1007/s10147-010-0157-3.
Warnakulasuriya, S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 582–590.
Staines, K.; Rogers, H. Oral leukoplakia and proliferative verrucous leukoplakia: A review for dental
Speight, P.M.; Khurram, S.A.; Kujan, O. Oral potentially malignant disorders: risk of progression to malignancy. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018.
Napier, S.S.; Speight, P.M. Natural history of potentially malignant oral lesions and conditions: An overview of the literature. J. Oral Pathol. Med. 2008, 37, 1–10.
Carrard, V.; van der Waal, I. A Clinical Diagnosis of Oral Leukoplakia . Med Oral Patol Oral Cir Bucal 2018.
Sundberg, J.; Korytowska, M.; Holmberg, E.; Bratel, J.; Wallström, M.; Kjellström, E.; Blomgren, J.; Kovács, A.; Öhman, J.; Sand, L.; et al. Recurrence rates after surgical removal of oral leukoplakia-A prospective longitudinal multicentre study. PLoS One 2019, 14, doi:10.1371/journal.pone.0225682.
Petti, S. Pooled estimate of world leukoplakia prevalence: A systematic review. Oral Oncol. 2003,
Villa, A.; Sonis, S. Oral leukoplakia remains a challenging condition. Oral Dis. 2018, 24, 179–183, doi:10.1111/odi.12781.
Mello, F.W.; Miguel, A.F.P.; Dutra, K.L.; Porporatti, A.L.; Warnakulasuriya, S.; Guerra, E.N.S.; Rivero, E.R.C. Prevalence of oral potentially malignant disorders: A systematic review and
Jayasooriya, P.R.; Dayaratne, K.; Dissanayake, U.B.; Warnakulasuriya, S. Malignant transformation of oral leukoplakia: a follow-up study. Clin. Oral Investig. 2020, doi:10.1007/s00784-020-03322-4.
Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol. 2020, 102, doi:10.1016/j.oraloncology.2019.104550.
Arduino, P.; Bagan, J.; El-Naggar, A.; Carrozzo, M. Urban legends series: Oral leukoplakia. Oral Dis. 2013, 19, 642–659.
Villa, A.; Celentano, A.; Glurich, I.; Borgnakke, W.S.; Jensen, S.B.; Peterson, D.E.; Delli, K.; Ojeda, D.; Vissink, A.; Farah, C.S. World Workshop on Oral Medicine VII: Prognostic biomarkers in oral leukoplakia: A systematic review of longitudinal studies. Oral Dis. 2019, 25, 64–78.
Villa, A.; Woo, S. Bin Leukoplakia—A Diagnostic and Management Algorithm. J. Oral Maxillofac. Surg. 2017, 75, 723–734.
Syrjänen, S.; Lodi, G.; von Bültzingslöwen, I.; Aliko, A.; Arduino, P.; Campisi, G.; Challacombe, S.; Ficarra, G.; Flaitz, C.; Zhou, H.; et al. Human papillomaviruses in oral carcinoma and oral potentially malignant disorders: A systematic review. Oral Dis. 2011, 17, 58–72, doi:10.1111/j.1601-0825.2011.01792.x.
Varoni, E.M.; Lombardi, N.; Franchini, R.; D’Amore, F.; Noviello, V.; Cassani, B.; Moneghini, L.; Sardella, A.; Lodi, G. Oral Human Papillomavirus (HPV) and sexual behaviors in a young cohort of oral cancer survivors. Oral Dis. 2020, odi.13622, doi:10.1111/odi.13622.
Awadallah, M.; Idle, M.; Patel, K.; Kademani, D. Management update of potentially premalignant oral epithelial lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2018, 125, 628–636.
Warnakulasuriya, S.; Johnson, N.W.; Van Der Waal, I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J. Oral Pathol. Med. 2007, 36, 575–580.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; present concepts of management. Oral Oncol. 2010, 46, 423–425.
Pentenero, M.; Meleti, M.; Vescovi, P.; Gandolfo, S. Oral proliferative verrucous leucoplakia: Are there particular features for such an ambiguous entity? A systematic review. Br. J. Dermatol. 2014, 170, 1039–1047.
Lombardi, N.; D’amore, F.; Elli, C.; Pispero, A.; Moneghini, L.; Franchini, R. Gingival lesion in proliferative verrucous leukoplakia. Dent. Cadmos 2020, 88, 647–648, doi:10.19256/d.cadmos.10.2020.03.
Hansen, L.S.; Olson, J.A.; Silverman, S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surgery, Oral Med. Oral Pathol. 1985, doi:10.1016/0030-4220(85)90313-5.
Villa, A.; Menon, R.S.; Kerr, A.R.; De Abreu Alves, F.; Guollo, A.; Ojeda, D.; Woo, S.B. Proliferative leukoplakia: Proposed new clinical diagnostic criteria. Oral Dis. 2018, 24, 749–760,
Aguirre-Urizar, J.M. Proliferative multifocal leukoplakia better name that proliferative verrucous leukoplakia. World J. Surg. Oncol. 2011, 9.
Lombardi, N.; Varoni, E.M.; Moneghini, L.; Lodi, G. Submucosal oral squamous cell carcinoma of the tongue. Oral Oncol. 2020, 105121, doi:10.1016/j.oraloncology.2020.105121.
Lodi, G.; Tarozzi, M.; Baruzzi, E.; Costa, D.; Franchini, R.; D’Amore, F.; Carassi, A.; Lombardi, N. Odontoiatria e cancro della bocca: dai fattori di rischio alla riabilitazione – Modulo 1: Epidemiologia e fattori di rischio. Dent. Cadmos 2021, 89, 01, doi:10.19256/d.cadmos.01.2021.14.
Lombardi, N.; Sorrentino, D.; D’amore, F.; Moneghini, L.; Franchini, R.; Sardella, A. Oral erythroleukoplakia on the lateral border of the tongue in a young patient. Dent. Cadmos 2020, 88, 277–278, doi:10.19256/d.cadmos.05.2020.03.
Warnakulasuriya, S.; Ariyawardana, A. Malignant transformation of oral leukoplakia: A systematic review of observational studies. J. Oral Pathol. Med. 2016, 45, 155–166, doi:10.1111/jop.12339.
Ho, M.W.; Risk, J.M.; Woolgar, J.A.; Field, E.A.; Field, J.K.; Steele, J.C.; Rajlawat, B.P.; Triantafyllou, A.; Rogers, S.N.; Lowe, D.; et al. The clinical determinants of malignant transformation in oral epithelial dysplasia. Oral Oncol. 2012, 48, 969–976, doi:10.1016/j.oraloncology.2012.04.002.
Field, E.A.; McCarthy, C.E.; Ho, M.W.; Rajlawat, B.P.; Holt, D.; Rogers, S.N.; Triantafyllou, A.; Field, J.K.; Shaw, R.J. The management of oral epithelial dysplasia: The Liverpool algorithm. Oral Oncol. 2015, 51, 883–887.
van der Waal, I. Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncol. 2009.
Diz P, Gorsky M, Johnson NW, Kragelund C, Manfredi M, Odell E, et al. Oral leukoplakia and erythroplakia: a protocol for diagnosis and management. EAOM – Diagnostic Ther. Protoc. 2011, 1, 1-8.
Van der Waal, I.; Axéll, T. Oral leukoplakia: A proposal for uniform reporting. Oral Oncol. 2002, 38, 521–526.
Reddi, S.P.; Shafer, A.T. Oral Premalignant Lesions: Management Considerations. Oral Maxillofac. Surg. Clin. North Am. 2006, 18, 425–433.
Pereira, J.D.S.; Carvalho, M.D.V.; Henriques, Á.C.G.; De Queiroz Camara, T.H.; Miguel, M.C.D.C.; Freitas, R.D.A. Epidemiology and correlation of the clinicopathological features in oral epithelial dysplasia: Analysis of 173 cases. Ann. Diagn. Pathol. 2011, 15, 98–102, doi:10.1016/j.anndiagpath.2010.08.008.
Rock, L.D.; Rosin, M.P.; Zhang, L.; Chan, B.; Shariati, B.; Laronde, D.M. Characterization of epithelial oral dysplasia in non-smokers: First steps towards precision medicine. Oral Oncol. 2018, 78, 119–125, doi:10.1016/j.oraloncology.2018.01.028.
Dilhari, A.; Weerasekera, M.M.; Siriwardhana, A.; Maheshika, O.; Gunasekara, C.; Karunathilaka, S.; Nagahawatte, A.; Fernando, N. Candida infection in oral leukoplakia: an unperceived public health problem. Acta Odontol. Scand. 2016, 74, 565–569, doi:10.1080/00016357.2016.1220018.
Speight, P.M. Update on oral epithelial dysplasia and progression to cancer. Head Neck Pathol. 2007, 1, 61–66, doi:10.1007/s12105-007-0014-5.
Warnakulasuriya, S.; Kovacevic, T.; Madden, P.; Coupland, V.H.; Sperandio, M.; Odell, E.; Møller, H. Factors predicting malignant transformation in oral potentially malignant disorders among patients accrued over a 10-year period in South East England. J. Oral Pathol. Med. 2011, 40, 677–683, doi:10.1111/j.1600-0714.2011.01054.x.
Arduino, P.G.; Surace, A.; Carbone, M.; Elia, A.; Massolini, G.; Gandolfo, S.; Broccoletti, R. Outcome of oral dysplasia: A retrospective hospital-based study of 207 patients with a long follow-up. J. Oral Pathol. Med. 2009, 38, 540–544, doi:10.1111/j.1600-0714.2009.00782.x.
Watabe, Y.; Nomura, T.; Onda, T.; Yakushiji, T.; Yamamoto, N.; Ohata, H.; Takano, N.; Shibahara, T. Malignant transformation of oral leukoplakia with a focus on low-grade dysplasia. J. Oral Maxillofac. Surgery, Med. Pathol. 2016, 28, 26–29, doi:10.1016/j.ajoms.2015.02.007.
Kujan, O.; Oliver, R.J.; Khattab, A.; Roberts, S.A.; Thakker, N.; Sloan, P. Evaluation of a new binary system of grading oral epithelial dysplasia for prediction of malignant transformation. Oral Oncol. 2006, doi:10.1016/j.oraloncology.2005.12.014.
El-Naggar A.K., Chan J.K.C., Grandis J.R., Takata T., S.P.J. WHO classification of Head and Neck tumors; 4th ed.; IARC Press: Lyon, 2017; ISBN 9789283224372.
Thomson, P. Oral Precancer; Thomson, P., Ed.; John Wiley & Sons, Ltd.: West Sussex, UK, 2012; ISBN 9781118702840.
Warnakulasuriya, S.; Reibel, J.; Bouquot, J.; Dabelsteen, E. Oral epithelial dysplasia classification systems: Predictive value, utility, weaknesses and scope for improvement. J. Oral Pathol. Med. 2008, 37, 127–133.
Pentenero, M.; Carrozzo, M.; Pagano, M.; Galliano, D.; Broccoletti, R.; Scully, C.; Gandolfo, S. Oral mucosal dysplastic lesions and early squamous cell carcinomas: Underdiagnosis from incisional biopsy. Oral Dis. 2003, 9, 68–72, doi:10.1034/j.1601-0825.2003.02875.x.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chen, Y.J.; Chiang, C.P.; Liu, B.Y.; Jeng, J.H.; Chang, H.H.; Kuo, Y.S.; Lan, W.H.; et al. Carcinoma and dysplasia in oral leukoplakias in Taiwan: Prevalence and risk factors. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2006, 101, 472–480, doi:10.1016/j.tripleo.2005.07.024.
Cabay, R.J.; Morton, T.H.; Epstein, J.B. Proliferative verrucous leukoplakia and its progression to oral carcinoma: A review of the literature. J. Oral Pathol. Med. 2007, 36, 255–261, doi:10.1111/j.1600-0714.2007.00506.x.
Iocca, O.; Sollecito, T.P.; Alawi, F.; Weinstein, G.S.; Newman, J.G.; De Virgilio, A.; Di Maio, P.; Spriano, G.; Pardiñas López, S.; Shanti, R.M. Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype. Head Neck 2020, 42, 539–555.
Bagan, J.; Murillo-Cortes, J.; Poveda-Roda, R.; Leopoldo-Rodado, M.; Bagan, L. Second primary tumors in proliferative verrucous leukoplakia: a series of 33 cases. Clin. Oral Investig. 2020, 24, 1963–1969, doi:10.1007/s00784-019-03059-9.
Reibel, J.; Gale, N.; Hille, J.; Hunt, J.; Lingen, M.; Muller, S.; Sloan, P.; Tilakaratne, W.; Westra, W.; Williams, M.; et al. Oral potentially malignant disorders and oral epithelial dysplasia. In WHO classification of head and neck tumours; IARC, Ed.; Lyon France, 2017; pp. 112–115 ISBN 9789283224389.
Ranganathan, K.; Kavitha, L. Oral epithelial dysplasia: Classifications and clinical relevance in risk assessment of oral potentially malignant disorders. J. Oral Maxillofac. Pathol. 2019, 23, 19–27.
Barnes, L.; Eveson, J.W.; Reichart, P.; Sidransky, D. World Health Organization Classification of Tumours. Pathology & Genetics. Head and Neck Tumours. International Agency for Research on Cancer (IARC). WHO Classif. Tumours (3rd Ed. 2005, 177–80.
Lee, J.J.; Hung, H.C.; Cheng, S.J.; Chiang, C.P.; Liu, B.Y.; Yu, C.H.; Jeng, J.H.; Chang, H.H.; Kok, S.H. Factors associated with underdiagnosis from incisional biopsy of oral leukoplakic lesions. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 2007, 104, 217–225, doi:10.1016/j.tripleo.2007.02.012.
Meleti, M.; Giovannacci, I.; Vescovi, P.; Pedrazzi, G.; Govoni, P.; Magnoni, C. Histopathological determinants of autofluorescence patterns in oral carcinoma. Oral Dis. 2020, doi:10.1111/odi.13304.
Tiwari, L.; Kujan, O.; Farah, C.S. Optical fluorescence imaging in oral cancer and potentially malignant disorders: A systematic review. Oral Dis. 2020.
Warnakulasuriya, S. White, red, and mixed lesions of oral mucosa: A clinicopathologic approach to diagnosis. Periodontol. 2000 2019, 80, 89–104.
Auluck, A.; Pai, K.M. (Mis)interpretations of leukoplakia. J. Can. Dent. Assoc. (Tor). 2005.
Müller, S. Frictional Keratosis, Contact Keratosis and Smokeless Tobacco Keratosis: Features of Reactive White Lesions of the Oral Mucosa. Head Neck Pathol. 2019, 13, 16–24.
Kramer, I.R.; El, L.; Lee, K.W. The clinical features and risk of malignant transformation in sublingual keratosis. Br. Dent. J. 1978, 144, 171–180, doi:10.1038/sj.bdj.4804055.
Eversole, L.R.; Eversole, G.M.; Kopcik, J. Sanguinaria-associated oral leukoplakia: Comparison with other benign and dysplastic leukoplakic lesions. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 2000, 89, 455–464, doi:10.1016/S1079-2104(00)70125-9.
Gupta, P.C.; Mehta, F.S.; Daftary, D.K. Incidence rates of oral cancer and natural history of oral precancerous lesions in a 10-year follow-up study of Indian villagers. Community Dent. Oral Epidemiol. 1980, 8, 287–333, doi:10.1111/j.1600-0528.1980.tb01302.x.
Sreenivasa Bharath, T.; Govind Raj Kumar, N.; Nagaraja, A.; Saraswathi, T.R.; Suresh Babu, G.; Ramanjaneya Raju, P. Palatal changes of reverse smokers in a rural coastal Andhra population with review of literature. J. Oral Maxillofac. Pathol. 2015, 19, 182–187, doi:10.4103/0973-029X.164530.
Woo, S. Bin; Grammer, R.L.; Lerman, M.A. Keratosis of unknown significance and leukoplakia: A preliminary study. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. 2014, 118, 713–724, doi:10.1016/j.oooo.2014.09.016.
Villa, A.; Hanna, G.J.; Kacew, A.; Frustino, J.; Hammerman, P.S.; Woo, S. Bin Oral keratosis of unknown significance shares genomic overlap with oral dysplasia. Oral Dis. 2019, 25, 1707–1714, doi:10.1111/odi.13155.
Lodi, G.; Porter, S. Management of potentially malignant disorders: Evidence and critique. J. Oral Pathol. Med. 2008, 37, 63–69.
Kanatas, A.N.; Fisher, S.E.; Lowe, D.; Ong, T.K.; Mitchell, D.A.; Rogers, S.N. The configuration of clinics and the use of biopsy and photography in oral premalignancy: A survey of consultants of the British Association of Oral and Maxillofacial Surgeons. Br. J. Oral Maxillofac. Surg. 2011, 49, 99–105, doi:10.1016/j.bjoms.2010.01.016.
Kumar, A.; Cascarini, L.; McCaul, J.A.; Kerawala, C.J.; Coombes, D.; Godden, D.; Brennan, P.A. How should we manage oral leukoplakia? Br. J. Oral Maxillofac. Surg. 2013, 51, 377–383, doi:10.1016/j.bjoms.2012.10.018.
Dionne, K.R.; Warnakulasuriya, S.; Zain, R.B.; Cheong, S.C. Potentially malignant disorders of the oral cavity: Current practice and future directions in the clinic and laboratory. Int. J. Cancer 2015, 136, 503–515.
Diajil, A.; Robinson, C.M.; Sloan, P.; Thomson, P.J. Clinical Outcome Following Oral Potentially Malignant Disorder Treatment: A 100 Patient Cohort Study. Int. J. Dent. 2013, 2013, 1–8, doi:10.1155/2013/809248.
Ribeiro, A.S.; Salles, P.R.; da Silva, T.A.; Mesquita, R.A. A Review of the Nonsurgical Treatment of Oral Leukoplakia. Int. J. Dent. 2010, 2010, 1–10, doi:10.1155/2010/186018.
Jaiswal, G.; Jaiswal, S.; Kumar, R.; Sharma, A. Field cancerization: concept and clinical implications in head and neck squamous cell carcinoma. J. Exp. Ther. Oncol. 2013.
Arduino, P.G.; Lodi, G.; Cabras, M.; Macciotta, A.; Gambino, A.; Conrotto, D.; Karimi, D.; El Haddad, G.; Carbone, M.; Broccoletti, R. A Randomized Controlled Trial on Efficacy of Surgical Excision of non-dysplastic Leukoplakia to Prevent Oral Cancer. Cancer Prev. Res. 2020, canprevres.0234.2020, doi:10.1158/1940-6207.capr-20-0234.
Mehanna, H.M.; Rattay, T.; Smith, J.; McConkey, C.C. Treatment and follow-up of oral dysplasia – A systematic review and meta-analysis. Head Neck 2009, doi:10.1002/hed.21131.
Saito, T.; Sugiura, C.; Hirai, A.; Notani, K.I.; Totsuka, Y.; Shindoh, M.; Fukuda, H. Development of squamous cell carcinoma from pre-existent oral leukoplakia: With respect to treatment modality. Int. J. Oral Maxillofac. Surg. 2001, 30, 49–53.
Zhang, L.; Lubpairee, T.; Laronde, D.M.; Rosin, M.P. Should severe epithelial dysplasia be treated? Oral Oncol. 2016, 60, 125–129, doi:10.1016/j.oraloncology.2016.07.007.
Balasundaram, I.; Payne, K.F.B.; Al-Hadad, I.; Alibhai, M.; Thomas, S.; Bhandari, R. Is there any benefit in surgery for potentially malignant disorders of the oral cavity? J. Oral Pathol. Med. 2014.
Thomson, P.J.; McCaul, J.A.; Ridout, F.; Hutchison, I.L. To treat…or not to treat? Clinicians’ views on the management of oral potentially malignant disorders. Br. J. Oral Maxillofac. Surg. 2015, 53, 1027–1031, doi:10.1016/j.bjoms.2015.08.263.
Kuribayashi, Y.; Tsushima, F.; Morita, K.; Matsumoto, K.; Sakurai, J.; Uesugi, A.; Sato, K.; Oda, S.; Sakamoto, K.; Harada, H. Long-term outcome of non-surgical treatment in patients with oral leukoplakia. Oral Oncol. 2015, 51, 1020–1025, doi:10.1016/j.oraloncology.2015.09.004.
Mogedas-Vegara, A.; Hueto-Madrid, J.A.; Chimenos-Küstner, E.; Bescós-Atín, C. Oral leukoplakia treatment with the carbon dioxide laser: A systematic review of the literature. J. Cranio-Maxillofacial Surg. 2016, doi:10.1016/j.jcms.2016.01.026.







