El lupus eritematoso discoide (LED) es una afección inflamatoria crónica que afecta la piel y la mucosa oral. El LED es la variante más frecuente del lupus cutáneo crónico y comprende el 80 % de los casos. La fisiopatología de la enfermedad es compleja e involucra múltiples factores, incluidos la genética, los factores ambientales y el sistema inmunitario innato y adaptativo. Los desencadenantes ambientales más comunes para LED incluyen la radiación ultravioleta, las drogas, la radioterapia y el tabaquismo.
Epidemiología
- La prevalencia del LED oscila entre 9 y 70 casos por 100 000 habitantes.
- La incidencia del LED es de 3 a 5 veces mayor entre los asiáticos y los individuos de raza negra en comparación con los caucásicos.
- Afecta predominantemente a mujeres (proporción hombres/mujeres : 1:3)
- Más frecuente entre los 20 y 40 años
- Las lesiones orales están presentes en el 20% de los pacientes con LED.
- La aparición de lesiones orales en pacientes con LED sin compromiso cutáneo es rara y se observa en el 10% de los casos.
Presentación Clíica
- La presentación más común del lupus cutáneo crónico es el LED que puede ocurrir como tipo localizado (80% de los casos) con lesiones que se presentan en la cara, las orejas y el cuero cabelludo.
- El LED diseminado (20 % de los casos) se presenta con lesiones por encima y por debajo del cuello y se asocia con un mayor riesgo de progresión a lupus eritematoso sistémico
Lesiones cutáneas:
- Las lesiones cutáneas del LED se presentan en áreas de la cara y cuello expuestas al sol, mostrando eritema anular e hiperqueratosis folicular. Se ha descrito una placa característica sobre el área malar de la cara y el puente de la nariz en forma de alas de mariposa.
- Las lesiones cutáneas pueden ir acompañadas de picor o sensación de ardor.
- A medida que progresan las lesiones cutáneas, se produce atrofia central, cicatrización, telangiectasia e hipopigmentación. También se produce alopecia cicatricial irreversible en el cuero cabelludo
Lesiones Orales:
- Las lesiones orales ocurren en aproximadamente el 20% de los casos y típicamente afectan los labios, el paladar duro y la mucosa bucal.
- Las lesiones de LED oral se caracterizan por la presencia de eritema central o ulceración rodeada de pápulas hiperqueratósicas o estrías radiadas y telangiectasias periféricas (Figuras 1 y 2). La apariencia de “panal de abeja” ocurre en lesiones de larga duración.
- Las lesiones de la mucosa pueden ocurrir sin afectación de la piel o previas al desarrollo de las lesiones cutáneas. Las lesiones del labio pueden extenderse para afectar la piel adyacente, borrando el borde bermellón.
- También puede aparecer gingivitis descamativa que afecte la encía inferior y/o superior.
- Tras su cicatrización, las lesiones erosivas pueden dejar pigmentación posinflamatoria.
- Los síntomas más comunes del LED incluyen la sensación de ardor, fotosensibilidad, sequedad, sensibilidad y dolor, aunque las lesiones pueden ser asintomáticas.
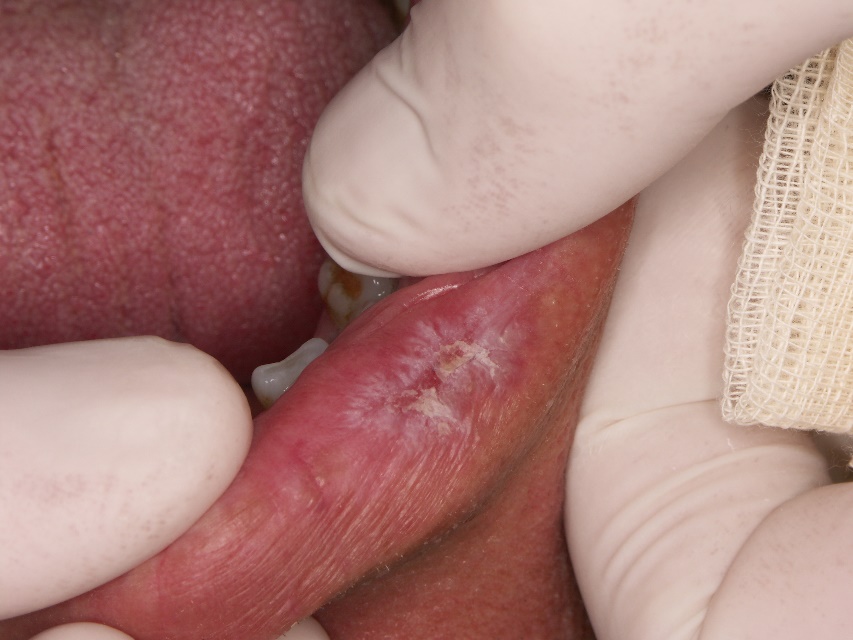
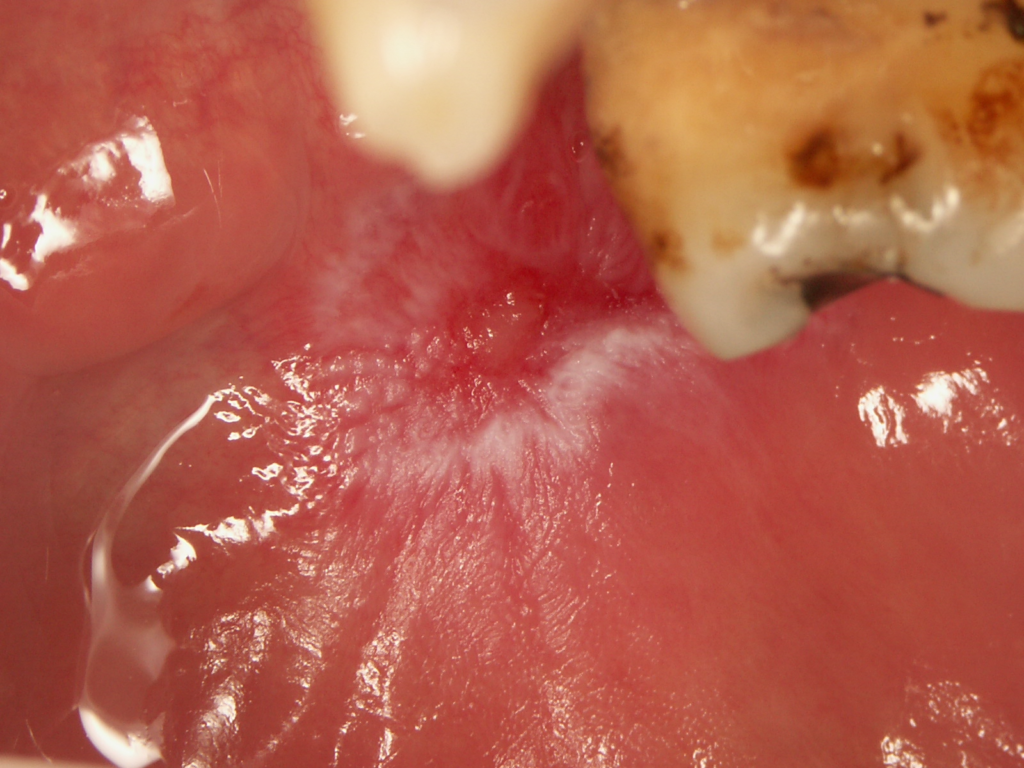
- Los pacientes con LED tienen un mayor riesgo de cáncer, incluido el cáncer de piel no melanocítico y el cáncer oral, en comparación con la población general.
- La Organización Mundial de la Salud clasificó el LED como un Trastorno Oral Potencialmente Maligno, aunque la transformación maligna es rara.
- Más comúnmente, la transformación maligna ocurre en las lesiones de LED localizadas en el borde bermellón del labio, y el labio inferior se ve afectado con mayor frecuencia.
- La exposición a la luz ultravioleta a largo plazo, la cicatrización crónica, la infección por VPH y la terapia inmunosupresora a largo plazo pueden ser factores predisponentes para el desarrollo del carcinoma de células escamosas labial. La duración media desde el inicio del LED hasta el desarrollo del carcinoma de labio es más corta en comparación con los cánceres que se originan a partir de lesiones de LED en otras localizaciones (10 a 13 años frente a 19 a 26 años).
- Los cánceres relacionados con el LED son más agresivos y tienen un mayor potencial metastásico (10-25 %), mayores tasas de recurrencia (27-29 %) y mayor mortalidad (19,4 %) en comparación con los cánceres no relacionados con el LED (20%, 0,5-6% y 1%, respectivamente)
Diagnóstico diferencial
El diagnóstico diferencial de las lesiones orales del LED incluye el liquen plano oral (LPO), reacciones liquenoides, leucoplasia oral y queilitis actínica (cuando afecta el labio inferior).
En el caso del LPO, las lesiones están más extendidas y distribuidas de forma más simétrica, y el patrón reticular es más pronunciado a diferencia de las lesiones orales del LED.
Las lesiones liquenoides por contacto se presentan como estrías blancas en sitios directamente en contacto con restauraciones de amalgama. Una vez retirada la restauración, la lesión puede mejorar o desaparecer.
La leucoplasia oral no presenta un patrón de estrías hiperqueratósicas radiantes y no suele presentar con atrofia central.
La queilitis actínica generalmente involucra el labio inferior, y suele presentar costras y sin formación de estrías.
Diagnóstico
- El diagnóstico de LED puede ser un desafío debido a las similitudes histopatológicas con el liquen plano oral.
- Los hallazgos histológicos del LED oral incluyen hiperqueratosis con formación de «tapones de queratina», atrofia de las crestas interepiteliales, degeneración hidrópica de la capa de células basales, mucositis de interfaz con infiltrado linfocítico perivascular superficial o profundo, edema en la lámina propia y engrosamiento PAS positivo de las paredes de los vasos sanguíneos (Figura 3).
![Figura 3: Histología del LED que se presenta con epitelio escamoso estratificado acantósico hiperqueratósico, zona libre de células yuxtaepiteliales y vasodilatación y edema en el tejido conjuntivo (tinción H y E, 450×) [imagen reproducida de Lallas et al, 2013 (11)].](https://opmdcare.com/wp-content/uploads//dle-image3-1024x643.jpeg)
- La inmunofluorescencia directa (IFD) puede ser útil para el diagnóstico diferencial. Las lesiones de LED muestran depósitos lineales o granulares de IgM, IgG y complemento 3 (C3) en la zona de la membrana basal, la «banda lúpica» (Figura 4).
- En contraste con lo que ocurre con el LED, en el LPO se pueden encontrar depósitos de fibrinógeno a lo largo de la membrana basal en el 90-100% de los casos. Debido a la marcada diferencia en los hallazgos de la IFD entre el LED y el liquen plano oral, muchos autores creen que la IFD debe ser parte del proceso de diagnóstico.
![Figura 4: Inmunofluorescencia directa (IFD) del LED que muestra el depósito de IgM en un patrón granular lineal en la zona de la membrana basal (banda lúdica) [Imagen reproducida de Bhushan et al, 2017 (28)].](https://opmdcare.com/wp-content/uploads/dle-image4.jpeg)
- Se pueden detectar anomalías serológicas y hematológicas en pacientes con LED. En algunos casos, la tasa de sedimentación eritrocítica (SER) puede estar elevada. Aproximadamente el 20% de los pacientes tienen anticuerpos antinucleares (ANA) positivos y hasta el 20% tienen autoanticuerpos SS-A. Los autoanticuerpos anti-Sm, que generalmente se observan en el lupus eritematoso sistémico, pueden ocurrir en el 5-20% de los pacientes con LED.
Manejo
- Los pacientes deben ser conscientes de la posibilidad de progresar a una enfermedad sistémica. El riesgo de progresión del LED hacia un Lupus Eritematoso Sistémico (LES) es del 16,7 % en los 3 años posteriores al diagnóstico y del 17 % en los 8 años posteriores al diagnóstico. Las medidas preventivas incluyen evitar la exposición a los rayos UV y el abandono del hábito tabáquico.
- Existe alguna evidencia sobre el uso de crema de fluocinonida tópica, hidroxicloroquina sistémica y acitretina en pacientes con LED cutáneo, la evidencia para el manejo del LED oral es escasa.
Lesiones Orales Localizadas:
- El tratamiento tópico es la primera línea de elección. Los corticosteroides tópicos (acetónido de triamcinolona, valerato de betametasona, dipropionato de clobetasol, hidrocortisona, acetónido de fluocinolona) son la base del tratamiento.
- También se pueden usar inhibidores de la calcineurina (tacrolimus, pimecrolimus).
- La inyección intralesional de corticosteroides (acetónido de triamcinolona) es útil para lesiones solitarias.
Lesiones recalcitrantes o generalizadas
- Con frecuencia se necesita terapia sistémica, por ejemplo, los antipalúdicos (hidroxicloroquina, cloroquina y quinacrina) solos o en combinación con corticosteroides sistémicos se usan como medicamentos sistémicos de primera línea.
- En casos más graves, inmunomoduladores (dapsona, talidomida, lenalidomida) y/o retinoides orales (acitretina, isotretinoína, alitretinoína) y/o inmunosupresores. (metotrexato, azatioprina, ciclofosfamida, micofenolato de mofetilo, micofenolato de sodio, ciclosporina).
- Los agentes biológicos (rituximab, belimumab) se utilizan en los casos más graves.
Los pacientes con LED deben ser monitoreados a intervalos regulares. La respuesta a la terapia difiere para cada paciente, variando desde unas pocas semanas hasta meses. Cada paciente debe manejarse individualmente con el fin de controlar los síntomas y vigilar la posible transformación maligna.
Referencias y Lecturas complementarias
Warnakulasurya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:582–90.
Stannard JN, Kahlenberg JN. Cutaneous lupus erythematosus: updates on pathogenesis and associations with systemic lupus. Curr Opin Rheumatol. 2016;28(5): 453–9.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Cutaneous lupus erythematosus and the association with systemic lupus erythematosus: a population-based cohort of 1088 patients in Sweden. Br J Dermatol. 2011;164(6):1335-41.
Blake SC, Daniel BS. Cutaneous lupus erythematosus: A review of the literature. Int J Womens Dermatol. 2019;5(5):320-9.
Szczęch J, Samotij D, Werth DP, Reich A. Trigger factors of cutaneous lupus erythematosus: a review of current literature. Lupus. 2017;26(8):791-807.
Izmirly PM, Buyon JP, Belmont HM, Sahl S, Wan I, Salmon JE et al. Population-based prevalence and incidence estimates of primary discoid lupus erythematosus from the Manhattan Lupus Surveillance Program. Lupus Sci Med. 2019;6(1):e000344.
Jarukitsopa S, Hoganson DDD, Crowson CS, Sokumbi O, Davis MD, Michet CJ et al. Epidemiology of Systemic Lupus Erythematosus and Cutaneous Lupus in a Predominantly White Population in the United States. Arthritis Care Res. 2015; 67(6): 817–28.
Drenkard C, Parker S, Aspey LD, Gordon C, Helmick CG, Bao G, Sam Lim S. Racial disparities in the incidence of primary chronic cutaneous lupus erythematosus in the southeastern US: the Georgia lupus registry. Arthritis Care Res. 2019; 71:95–103.
Nico MMS, Apparecida M, Vileila C, Rivitti EA, Lourenco SV. Oral lesions in lupus erythematosus: correlation with cutaneous lesions. Eur J Dermatol 2008;18(4):376-81.
Menzies S, O’Shea F, Galvin S, Wynne B. Oral manifestations of lupus. Ir J Med Sci. 2018; 187:91–3.
Ranginwala AM, Chalishazar MM, Panja P, Buddhdev KP, Kale HM. Oral discoid lupus erythematosus: A study of twenty-one cases. J Oral Maxillofac Pathol. 2012;16(3): 368–73.
Lallas A, Apalla Z, Lefaki I, et al. Dermoscopy of discoid lupus erythematosus. Br J Dermatol 2013;168: 284–8.
McDaniel B, Sukumaran S,Tanner LS. Discoid Lupus Erythematosus. NCBI Bookshelf. A service of the National Library of Medicine, National Institutes of Health. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-.
Shafer WG, Hine MK, Levy BM. A textbook of oral pathology. 7th ed. Philadelphia: W B Saunders;1999. p. 8992.
Kranti K, Seshan H, Juliet J. Discoid lupus erythematosus involving gingiva. J Indian Soc Periodontol. 2012;16(1): 126–8.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Increased risk of cancer among 3663 patients with cutaneous lupus erythematosus: A Swedish nationwide cohort study. Br J Dermatol 2012; 166: 1053–1059.
de Berker D, Dissaneyeka M, Burge S. The sequelae of chronic cutaneous lupus erythematosus. Lupus 1992;1:181-6.
Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-580.
Arvanitidou IE, Nikitakis NG, Georgaki M, Papadogeorgakis N, Tzioufas A, Sklavounou A. Multiple primary squamous cell carcinomas of the lower lip and tongue arising in discoid lupus erythematosus: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:e22-e30.
Fernandes MS, Girisha BS, Viswanathan N, Sripathi H and Noronha TM. Discoid lupus erythematosus with squamous cell carcinoma: a case report and review of the literature in Indian patients. Lupus. 2015; 24: 1562–6.
Sherman RN, Lee CW, Flynn KJ. Cutaneous squamous cell carcinoma in black patients with chronic discoid lupus erythematosus. Int J Dermatol 1993; 32: 677–679.
Liu W, Shen ZY, Wang LJ, et al. Malignant potential of oral and labial chronic discoid lupus erythematosus: A clinicopathological study of 87 cases. Histopathology 2011; 59: 292–298.
Tao J, Zhang X, Guo N, et al. Squamous cell carcinoma complicating discoid lupus erythematosus in Chinese patients: Review of the literature, 1964–2010. J Am Dermatol 2012; 66: 695–696.
Makita E, Akasaka E, Sakuraba Y, Korekawa A, Aizu T, Kaneko T et al. Squamous cell carcinoma on the lip arising from discoid lupus erythematosus: a case report and review of Japanese patients. Eur J Dermatol. 2016;26(4):395-6.
Naik V, Prakash S. Oral Discoid Lupus Erythematosus: A Case Effectively Managed and Differentiated with other Overlapping Diseases. Indian J Dent Adv 2018;9(4): 221-5.
Del Barrio‐Díaz P, Reyes‐Vivanco C, Cifuentes‐Mutinelli M, Manríquez J, Vera‐Kellet C. Association between oral lesions and disease activity in lupus erythematosus. J Eur Acad Dermatol Venereol. 2020;34(2):349-356.
Martins da Costa Marques ER, Silva R, Hsieh R. Oral Mucosal Manifestation of Lupus Erythematosus: A Short Review. DOBCR. doi: 10.31487/j.DOBCR.2020.02.09
Bhushan R, Agarwal S, Chander R, Agarwal K. Direct Immunofluorescence Study in Discoid Lupus Erythematosus. World Journal of Pathology 2017; 9:56-60.
Biazar C. Sigges J. Patsinakidis N. Ruland V. Amler S. Bonsmann G. Kuhn A. Cutaneous lupus erythematosus: first multicenter database analysis of 1002 patients from the European Society of Cutaneous Lupus Erythematosus (EUSCLE).Autoimmun Rev. 2013; 12(3):444-454.
Wieczorek I.T., Propert K.J., Okawa J, Werth V.P. Systemic symptoms in the progression of cutaneous to systemic lupus erythematosus. JAMA Dermatol. 2014; 150(3):291-6.
Jessop S, Whitelaw DA, Grainge MJ, Jayasekera P. Drugs for discoid lupus erythematosus. Cochrane Database Syst Rev. 2017;5(5):CD002954.
Okon LG, Werth VP. Cutaneous lupus erythematosus: diagnosis and treatment. Best Pract Res Clin Rheumatol. 2013;27: 391-404.







