La Organización Mundial de la Salud (OMS) definió originalmente la eritroplasia como “cualquier lesión de la mucosa oral que se presente como placas aterciopeladas de color rojo brillante que no pueden caracterizarse clínica o patológicamente como ninguna otra enfermedad reconocible”. No existe una definición universalmente aceptada de eritroplasia oral, sin embargo, la mayoría de las definiciones modernas son más o menos reductoras de la definición original de la OMS. La definición más utilizada en la literatura describe la eritroplasia oral como «una mancha roja que no puede caracterizarse clínica o patológicamente como ninguna otra lesión definible».
Se ha utilizado otras terminologías, como eritroleucoplasia, leucoeritroplasia y eritroplasia moteada, para describir una mezcla de placas rojas y blancas.
Etiopatogenesis
- Muchos de los principales factores etiológicos del cáncer oral son también factores contribuyentes o etiológicos del desarrollo de la eritroplasia oral .
- Se ha observado que estos factores contribuyen a la transformación maligna de la eritroplasia, sin embargo, su papel en la etiopatogenia de la eritroplasia es poco conocido.
- Estos factores son principalmente mascar nuez de betel, mascar tabaco, fumar tabaco y consumir alcohol. Otros posibles factores etiológicos implicados incluyen el índice de masa corporal (IMC) y el estado nutricional
- El virus del papiloma humano (VPH) también se ha mencionado como un posible factor contribuyente o cofactor etiológico.
Porque el color rojo?
- El análisis histopatológico revela displasia (que varía de leve a severa), carcinoma in situ o carcinoma de células escamosas en el 60-90% de los casos. Estas descripciones microscópicas explicarían el color rojo intenso de las lesiones.
- Existe una ausencia de queratina superficial que normalmente dispersaría y reduciría la intensidad del color rojo.
- También hay una reducción en la profundidad de la capa epitelial; por lo tanto, la vasculatura presente en el tejido conjuntivo es más visible desde la superficie.
- Finalmente, el número de estructuras vasculares aparece aumentada en respuesta a la inflamación.
Epidemiología
- La tasa de prevalencia varía de aproximadamente 0,02 a 2%.
- Está ampliamente aceptado que la prevalencia de la eritroplasia oral es menor que la de otros TOPMs.
- No parece haber predilección por género, a pesar de que estudios iniciales describieron un predominio por el género masculino.
- La eritroplasia parece ocurrir principalmente en personas de mediana edad y ancianos
- No se conoce una distribución geográfica de la eritroplasia, sin embargo, la prevalencia es notablemente más alta en poblaciones con un hábito preexistente de fumar y masticar nuez de betel.
Presentación clínica
- Se presenta como una mácula o placa de color rojo intenso con una textura aterciopelada suave.
- Típicamente suave a la palpación, se observa induración en casos de malignidad.
- Las lesiones suelen ser de contorno irregular, aunque bien definidas. Ocasionalmente la superficie puede aparecer granular.
- Por lo general son asintomáticas, aunque los pacientes pueden referir dolor o ardor no específico en el área.
ERITROLEUCOPLASIA
- Las áreas rojas muestran atrofia o adelgazamiento del epitelio y, a diferencia de la eritroplasia o la leucoplasia, pueden presentarse con un margen irregular.
- La eritroleucoplasia suele presentar síntomas con mayor frecuencia.
- El suelo de boca, la cara ventral de la lengua, el paladar blando, las fauces amigdalinas y la mucosa yugal son las localizaciones afectas con mayor frecuencia.
- Por lo general, las lesiones son pequeñas (menos de 1,5 cm), aunque pueden aparecer lesiones más grandes (> 4 cm).
- La eritroplasia raramente afecta múltiples localizaciones.
- En casos de transformación maligna, los pacientes pueden presentar signos y síntomas de carcinoma oral de células escamosas (COCE).
- No existe una clasificación ampliamente aceptada de la eritroplasia.
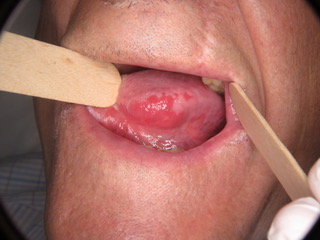
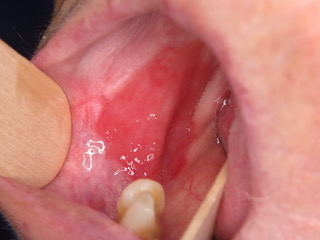
Figura 1: 1a)Eritroplasia extensa que afecta homogéneamente el borde lateral izquierdo de la lengua, y 1b) Eritroplasia homogénea que afecta la región posterior de la mucosa yugal derecha..
Diagnóstico Diferencial
La lista de posibles diagnósticos diferenciales incluye aquellas lesiones que se presentan con mucosa oral eritematosa. La candidiasis eritematosa y el liquen plano atrófico se citan con frecuencia como los más comunes.
La candidiasis eritematosa y la estomatitis protésica se pueden diferenciar de la eritroplasia, ya que con frecuencia estas áreas eritematosas se resuelven con instrucciones sobre higiene bucal/prótesis y tratamiento con antimicóticos, tanto agentes sistémicos como tópicos.
La candidiasis eritematosa puede presentarse de manera asintomática, con áreas eritematosas centrales que afectan la superficie dorsal de la lengua, con una lesión «en espejo» que afecta el paladar.
Otras infecciones microbianas pueden presentarse con manifestaciones orales como manchas rojas que afectan la mucosa oral, incluyendo la histoplasmosis y la tuberculosis.
El liquen plano atrófico (rojo) tiende a presentar sintomatología, con otras características del LPO, como estrías blancas que afectan otras áreas de la mucosa oral. Las manifestaciones orales del lupus eritematoso sistémico (LES) se encuentran con frecuencia y pueden incluir eritema inespecífico.
Diagnóstico
- Una lesión solitaria con bordes bien delimitados ayuda a distinguir clínicamente la eritroplasia de otros trastornos.
- Estas lesiones solitarias pueden ser un hallazgo clínico ocasional durante la exploración rutinaria por los odontólogos, y debe ser motivo de derivación inmediata.
- La biopsia urgente es esencial para excluir un cambio neoplásico.
- Las características histopatológicas que se pueden encontrar han sido descritas anteriormente, epitelio delgado y atrófico, falta de queratina e hiperplasia, y diversos grados de displasia epitelial. La hematoxilina y eosina es la tinción más utilizada por los histopatólogos en el diagnóstico de eritroplasia.
Transformación Maligna:
- La tasa de transformación maligna varía del 14 al 50%.
- Muchas eritroplasias pueden presentarse con carcinoma in situ o invasivo en el momento del diagnóstico.
- La presencia de displasia de moderada a grave indica un riesgo considerablemente mayor de transformación maligna.
- Una revisión sistemática reciente calculó el riesgo general de transformación maligna en 33,1 % y una tasa de transformación maligna anual de 2,7 %.
Manejo
Debido al mayor riesgo de transformación maligna, el tratamiento temprano es crucial.
- La escisión quirúrgica es el tratamiento de elección.
- Faltan estudios sobre el seguimiento posterior a la escisión quirúrgica y los resultados del tratamiento.
- No existen pautas sobre el margen quirúrgico exacto para extirpar, esto a menudo lo dicta el grado de atipia celular identificado.
- La escisión con láser de dióxido de carbono se ha utilizado recientemente, como una alternativa a la escisión con bisturí. Esto se ha asociado con una cicatrización más favorable del área y una mayor comodidad postoperatoria.
- Se desconoce la tasa de recurrencia después de la escisión, sin embargo, se ha demostrado que el tamaño de la lesión extirpada es un factor predictivo significativo.
- Otras terapias que incluyen la vitamina A, retinoides, bleomicina y té mixto no han arrojado resultados favorables para recomendar su uso.
- Se debe recomendar el cese de hábitos recreativos asociados a un mayor riesgo de transformación maligna.
Seguimiento:
- No hay un consenso sobre el intervalo de seguimiento para la eritroplasia.
- Un aumento del tamaño, hábitos recreativos de alto riesgo (tabaquismo/alcohol), localizaciones de alto riesgo (cara ventral de la lengua y suelo de boca), cambios en la apariencia clínica y el desarrollo de síntomas pueden indicar una nueva biopsia de una lesión.
- Una fotografía clínica tomada en las visitas de seguimiento es útil para evaluar objetivamente cualquier cambio en la apariencia de la lesión.
Resumen
La definición más aceptada de eritroplasia es “cualquier lesión de la mucosa oral que se presente como placas aterciopeladas de color rojo brillante que no pueden caracterizarse clínica o patológicamente como ninguna otra afección reconocible”. El tabaquismo, el alcohol, la masticación de nuez de betel y las mutaciones genéticas pueden desempeñar un papel en la etiología. La eritroplasia es el TOPM con la tasa de prevalencia más baja y la tasa de transformación maligna más alta. Teniendo en cuenta la alta tasa de transformación maligna, se recomienda la biopsia incisional temprana para identificar cambios neoplásicos precoces. El tratamiento de elección para las lesiones de alto riesgo (displasia severa y carcinoma in situ) es la extirpación quirúrgica. Es necesario un seguimiento regular y con frecuencia es necesario la realización de nuevas biopsias.umbral para una nueva biopsia es bajo.
A pesar de la tasa de transformación maligna más alta entre los TOPMs, la eritroplasia sigue siendo el TOPM de menor comprensión. La ausencia de investigación en este área deja muchas preguntas sin respuesta sobre la etiología, la prevalencia, el diagnóstico y el tratamiento de la eritroplasia.
Referencias y lecturas complementarias
J.J. Pindborg, P.A. Reichart, C.J. Smith, I. van der Waal, in collaboration with Sobin LH and pathologists in 9 countries. Histological typing of cancer and precancer of the oral mucosa
(2nd ed.), Springer Verlag, Berlin, New York, Tokyo (1997)
C. Scully Oral and maxillofacial medicine the basis of diagnosis and treatment, Wright. Elsevier Science Ltd., Edinburgh, London, New York (2004), pp. 289-290
J. PHILIP SAPP DDS, MS, … GEORGE P. WYSOCKI DDS, PHD, in Contemporary Oral and Maxillofacial Pathology (Second Edition), 2004
Abati, S., Bramati, C., Bondi, S., Lissoni, A. and Trimarchi, M. (2020) ‘Oral Cancer and Precancer: A Narrative Review on the Relevance of Early Diagnosis’, Int J Environ Res Public Health, 17(24).
Al-Attas, S. A., Ibrahim, S. S., Amer, H. A., Darwish, Z. l.-S. and Hassan, M. H. (2014) ‘Prevalence of potentially malignant oral mucosal lesions among tobacco users in Jeddah, Saudi Arabia’, Asian Pac J Cancer Prev, 15(2), pp. 757-62.
Bouquot, J. E. and Ephros, H. (1995) ‘Erythroplakia: the dangerous red mucosa’, Pract Periodontics Aesthet Dent, 7(6), pp. 59-67; quiz 68.
Fatahzadeh, M. and Schwartz, R. A. (2013) ‘Oral Kaposi’s sarcoma: a review and update’, Int J Dermatol, 52(6), pp. 666-72.
Ferreira, A. M., de Souza Lucena, E. E., de Oliveira, T. C., da Silveira, É., de Oliveira, P. T. and de Lima, K. C. (2016) ‘Prevalence and factors associated with oral potentially malignant disorders in Brazil’s rural workers’, Oral Dis, 22(6), pp. 536-42.
Hashibe, M., Mathew, B., Kuruvilla, B., Thomas, G., Sankaranarayanan, R., Parkin, D. M. and Zhang, Z. F. (2000) ‘Chewing tobacco, alcohol, and the risk of erythroplakia’, Cancer Epidemiol Biomarkers Prev, 9(7), pp. 639-45.
Holmstrup, P. (2018) ‘Oral erythroplakia-What is it?’, Oral Dis, 24(1-2), pp. 138-143.
Holmstrup, P. and Pindborg, J. J. (1979) ‘Erythroplakic lesions in relation to oral lichen planus’, Acta Derm Venereol Suppl (Stockh), 59(85), pp. 77-84.
Iocca, O., Sollecito, T. P., Alawi, F., Weinstein, G. S., Newman, J. G., De Virgilio, A., Di Maio, P., Spriano, G., Pardiñas López, S. and Shanti, R. M. (2020) ‘Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype’, Head Neck, 42(3), pp. 539-555.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Kramer, I. R., Lucas, R. B., Pindborg, J. J. and Sobin, L. H. (1978) ‘Definition of leukoplakia and related lesions: an aid to studies on oral precancer’, Oral Surg Oral Med Oral Pathol, 46(4), pp. 518-39.
Lumerman, H., Freedman, P. and Kerpel, S. (1995) ‘Oral epithelial dysplasia and the development of invasive squamous cell carcinoma’, Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 79(3), pp. 321-9.
Mello, F. W., Miguel, A. F. P., Dutra, K. L., Porporatti, A. L., Warnakulasuriya, S., Guerra, E. N. S. and Rivero, E. R. C. (2018) ‘Prevalence of oral potentially malignant disorders: A systematic review and meta-analysis’, J Oral Pathol Med, 47(7), pp. 633-640.
MERRICKS, J. W. and COTTRELL, T. L. (1953) ‘Erythroplasia of Queyrat’, J Urol, 69(6), pp. 807-13.
Nielsen, H., Norrild, B., Vedtofte, P., Praetorius, F., Reibel, J. and Holmstrup, P. (1996) ‘Human papillomavirus in oral premalignant lesions’, Eur J Cancer B Oral Oncol, 32B(4), pp. 264-70.
O’Sullivan, E. M. (2011) ‘Prevalence of oral mucosal abnormalities in addiction treatment centre residents in Southern Ireland’, Oral Oncol, 47(5), pp. 395-9.
PINDBORG, J. J., RENSTRUP, G., POULSEN, H. E. and SILVERMAN, S. (1963) ‘STUDIES IN ORAL LEUKOPLAKIAS. V. CLINICAL AND HISTOLOGIC SIGNS OF MALIGNANCY’, Acta Odontol Scand, 21, pp. 407-14.
Reichart, P. A. and Philipsen, H. P. (2005) ‘Oral erythroplakia–a review’, Oral Oncol, 41(6), pp. 551-61.
Roza, A. L. O. C., Kowalski, L. P., William, W. N., de Castro, G., Chaves, A. L. F., Araújo, A. L. D., Ribeiro, A. C. P., Brandão, T. B., Lopes, M. A., Vargas, P. A., Santos-Silva, A. R. and Cancer, L. A. C. O. G. B. G. o. H. a. N. (2021) ‘Oral leukoplakia and erythroplakia in young patients: a systematic review’, Oral Surg Oral Med Oral Pathol Oral Radiol, 131(1), pp. 73-84.
Shafer, W. G. and Waldron, C. A. (1975) ‘Erythroplakia of the oral cavity’, Cancer, 36(3), pp. 1021-8.
Shear, M. (1972) ‘Erythroplakia of the mouth’, Int Dent J, 22(4), pp. 460-73.
Thavarajah, R., Rao, A., Raman, U., Rajasekaran, S. T., Joshua, E., R, H. and Kannan, R. (2006) ‘Oral lesions of 500 habitual psychoactive substance users in Chennai, India’, Arch Oral Biol, 51(6), pp. 512-9.
Villa, A., Villa, C. and Abati, S. (2011) ‘Oral cancer and oral erythroplakia: an update and implication for clinicians’, Aust Dent J, 56(3), pp. 253-6.
Warnakulasuriya, S. (2018) ‘Clinical features and presentation of oral potentially malignant disorders’, Oral Surg Oral Med Oral Pathol Oral Radiol, 125(6), pp. 582-590.
Yang, S. W., Lee, Y. S., Chang, L. C., Hsieh, T. Y. and Chen, T. A. (2015a) ‘Outcome of excision of oral erythroplakia’, Br J Oral Maxillofac Surg, 53(2), pp. 142-7.
Yang, S. W., Lee, Y. S., Chang, L. C., Hwang, C. C., Luo, C. M. and Chen, T. A. (2015b) ‘Clinical characteristics of narrow-band imaging of oral erythroplakia and its correlation with pathology’, BMC Cancer, 15, pp. 406.
Zaini, Z. M., McParland, H., Møller, H., Husband, K. and Odell, E. W. (2018) ‘Predicting malignant progression in clinically high-risk lesions by DNA ploidy analysis and dysplasia grading’, Sci Rep, 8(1), pp. 15874.
[/toggle]







