L’Organisation mondiale de la santé (OMS) a défini à l’origine l’érythroplasie comme « toute lésion de la muqueuse buccale se présentant sous forme de plaques veloutées rouge vif et ne pouvant être caractérisée cliniquement ou pathologiquement comme une autre affection reconnaissable ». Il n’existe pas de définition universellement acceptée de l’érythroplasie buccale, mais la majorité des définitions modernes sont plus ou moins réductrices de la définition originale de l’OMS. La définition la plus fréquemment utilisée dans la littérature décrit l’érythroplasie buccale comme « une tache rouge vif qui ne peut être caractérisée cliniquement ou pathologiquement comme une autre lésion définissable ».
D’autres termes tels que érythroleucoplasie, leuco-érythroplasie et érythroplasie mouchetée, ont été utilisés pour décrire un mélange de taches rouges et blanches.
Étiopathogénie
- Les principaux facteurs de risque du cancer de la cavité buccale sont des facteurs contributifs ou étiologiques du développement de l’érythroplasie.
- Il a été observé que ces facteurs contribuent à la transformation maligne de l’érythroplasie, mais leur rôle dans l’étiopathogénie de l’érythroplasie n’est pas complétement élucidé.
- Ces facteurs sont principalement la fait de macher de la chique de bétel, la mastication de tabac, le tabagisme et la consommation d’alcool. Les autres facteurs étiologiques possibles sont l’IMC et l’état nutritionnel.
- Le papillomavirus humain (HPV) a également été identifié comme un facteur contributif ou un cofacteur étiologique possible.
Pourquoi sont-elles rouge?
- L’analyse histopathologique révèle une dysplasie (légère à sévère), un carcinome in situ ou un carcinome épidermoïde dans 60 à 90 % des cas. Ces descriptions microscopiques expliqueraient la couleur rouge de ces lésions.
- Il y a un manque de kératine de surface qui devrait normalement disperser et atténuer l’intensité de la couleur rouge.
- On observe également une réduction de l’épaisseur de la couche épithéliale ; par conséquent, les vaisseaux présents dans le tissu conjonctif sont plus visibles en surface.
- Enfin, le nombre de structures vasculaires semble augmenter en réponse à l’inflammation.
Épidemiologie
- Le taux de prévalence varie de 0,02 à 2% environ.
- Il est largement admis que la prévalence de l’érythroplasie est inférieure à celle des autres LPM et à la leucoplasie orale.
- Il ne semble pas y avoir de prédilection en fonction du sexe, bien que des études antérieures aient signalé une prédominance masculine.
- L’érythroplasie semble survenir principalement chez les personnes d’âge moyen et les personnes âgées (Reichart et Philipsen, 2005).
- Il n’y a pas de donnée concernant la distribution géographique de l’érythroplasie, mais on observe que la prévalence est plus élevée dans les populations qui ont l’habitude de fumer et de mâcher des noix de bétel.
Manifestation clinique
- Se présente sous la forme d’une macule ou d’une plaque rouge vif avec une texture veloutée.
- Typiquement souple à la palpation, l’induration n’étant observée qu’en cas de malignité.
- Les lésions ont généralement un contour irrégulier, mais bien défini. Occasionnellement, cependant, la surface peut sembler granuleuse.
- Il n’y a généralement pas de symptômes. Les patients peuvent signaler une douleur non spécifique ou une brûlure de la zone. Une sensation de goût métallique a également été rapporté.
ERYTHROLEUCOPLASIE
- Les zones rouges montrent une atrophie ou un amincissement de l’épithélium et, contrairement à l’érythroplasie ou à la leucoplasie, elles peuvent présenter un bord irrégulier.
- L’érythroleucoplasie est plus souvent symptomatique.
- Le plancher de la bouche, la face ventrale de la langue, le palais mou, les amygdales et la muqueuse buccale sont les sites les plus fréquemment touchés.
- En général, les lésions sont petites (moins de 1,5 cm), mais des lésions plus grandes ont été rapportées (>4 cm).
- L’érythroplasie affecte rarement plusieurs sites.
- En cas de transformation maligne, les patients peuvent présenter des signes et des symptômes de carcinome épidermoïde oral (CEO).
- Il n’existe pas de classification reconnue de l’érythroplasie.
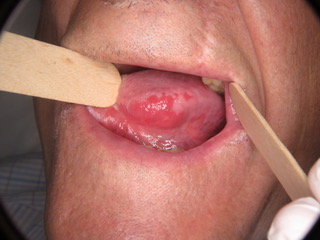
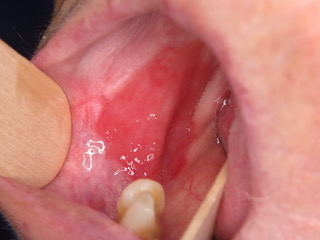
Figure 1 : Erythroplasie généralisée affectant de manière homogène le bord latéral gauche de la langue et érythroplasie homogène affectant la muqueuse buccale droite postérieure.
Diagnostic Differentiel
La liste des diagnostics différentiels comprend les lésions présentant une muqueuse buccale érythémateuse. La candidose érythémateuse et le lichen plan atrophique sont fréquemment cités comme les plus courants.
La candidose érythémateuse et la stomatite sous prothétique peuvent être différenciées de l’érythroplasie, car ces zones érythémateuses disparaissent souvent avec des consignes d’hygiène buccale/de prothèse dentaire et un traitement par antifongiques, qu’ils soient systémiques ou topiques.
La candidose érythémateuse peut se présenter de manière asymptomatique, avec des zones érythémateuses centrales affectant la face dorsale de la langue, avec une lésion en calque affectant le palais.
D’autres infections microbiennes peuvent présenter des manifestations buccales telles que des plaques rouges affectant la muqueuse buccale, notamment l’histoplasmose et la tuberculose.
Le lichen plan atrophique tend à se présenter de manière symptomatique, avec d’autres caractéristiques du LPO telles que des stries blanches affectant d’autres zones de la muqueuse buccale. Les manifestations buccales du lupus érythémateux systémique (LES) sont fréquentes et peuvent inclure un érythème non spécifique.
Diagnostic
- Une lésion isolée aux bords bien délimités aide le praticien à distinguer cliniquement l’érythroplasie d’autres affections.
- Ces lésions isolées peuvent être découvertes fortuitement par les chirurgiens-dentistes, ce qui incite à les adresser.
- Une biopsie doi être réalisée de façon urgente et est essentielle pour exclure une transformation néoplasique.
- Les caractéristiques histopathologiques que l’on peut trouver ont été décrites ci-dessus, épithélium mince et atrophié, absence de kératine et hyperplasie. L’hématoxyline et l’éosine sont les colorations les plus couramment utilisées par les histopathologistes pour le diagnostic de l’érythroplasie.
Transformation Maligne:
- Le taux de transformation maligne varie de 14 à 50%.
- De nombreuses lésions rouges peuvent présenter un carcinome in situ ou invasif au moment du diagnostic.
- La présence d’une dysplasie modérée à sévère indique un risque considérablement plus élevé de transformation maligne.
- Une récente revue systématique a rapporté que le risque global de transformation maligne était de 33,1% et que le taux de transformation maligne par an était de 2,7%.
Prise en charge
En raison du risque élevé de transformation maligne, un traitement précoce est crucial.
- L’exérèse chirurgicale est le traitement de choix.
- Il y a un manque de données sur le suivi après l’exérèse chirurgicale et les résultats du traitement.
- Il n’existe pas de recommandation sur la marge à prendre lors de l’exérèse, celle-ci est souvent dictée par le degré d’atypie cellulaire identifié.
- L’exérèse au laser à dioxyde de carbone a été utilisée récemment, comme alternative à l’exérèse à la lame froide. Cette technique a été associée à une meilleure cicatrisation de la zone et à un meilleur confort postopératoire.
- Le taux de récidive après exérèse est inconnu, mais il a été démontré que la taille de la lésion excisée était un facteur prédictif important.
- D’autres thérapies, notamment la vitamine A, les rétinoïdes, la bléomycine et le thé mixte, n’ont pas donné de résultats favorables pour préconiser leur utilisation.
- Il faut recommander l’abandon des habitudes récréatives associées à un risque plus élevé de transformation maligne.
Suivi:
- l n’y a pas d’intervalle de suivi suggéré pour l’érythroplasie.
- Une augmentation de la taille, des habitudes nocives à haut risque (tabac/alcool), des localisations à haut risque (langue ventrale et plancher buccal), un changement de l’aspect clinique et le développement de symptômes peuvent dicter une nouvelle biopsie d’une lésion.
- Une photographie clinique prise lors des rendez-vous suivants est utile pour évaluer objectivement tout changement d’aspect de la lésion.
Résumé
La définition la plus largement acceptée de l’érythroplasie est la suivante : » toute lésion de la muqueuse buccale se présentant sous forme de plaques veloutées rouge vif et ne pouvant être caractérisée cliniquement ou pathologiquement comme une autre affection reconnaissable « . Le tabagisme, l’alcool, la mastication de noix de bétel et les mutations génétiques peuvent tous jouer un rôle dans l’étiologie. L’érythroplasie est la LPM qui présente le taux de prévalence le plus faible et le taux de transformation maligne le plus élevé. Compte tenu du taux élevé de transformation maligne, une biopsie précoce est préconisée pour identifier les changements néoplasiques précoces. Le traitement de choix pour les lésions à haut risque (dysplasie sévère et carcinome in situ) est l’exérèse chirurgicale. Un suivi régulier est nécessaire et le seuil à partir duquel une nouvelle biopsie est nécessaire est faible.
Malgré le taux de transformation maligne le plus élevé parmi les LPM, l’érythroplasie reste la LPM la plus mal comprise. Le manque de recherche laisse de nombreuses questions sans réponse concernant l’étiologie, la prévalence, le diagnostic et la prise en charge de l’érythroplasie.
Références and Lectures Complémentaires
J.J. Pindborg, P.A. Reichart, C.J. Smith, I. van der Waal, en collaboration avec Sobin LH et des pathologistes de 9 pays. Caractérisation histologique des cancers et des LPM de la muqueuse buccale
(2nd ed.), Springer Verlag, Berlin, New York, Tokyo (1997)
C. Scully Oral and maxillofacial medicine the basis of diagnosis and treatment, Wright. Elsevier Science Ltd., Edinburgh, London, New York (2004), pp. 289-290
J. PHILIP SAPP DDS, MS, … GEORGE P. WYSOCKI DDS, PHD, in Contemporary Oral and Maxillofacial Pathology (Second Edition), 2004
Abati, S., Bramati, C., Bondi, S., Lissoni, A. and Trimarchi, M. (2020) ‘Oral Cancer and Precancer: A Narrative Review on the Relevance of Early Diagnosis’, Int J Environ Res Public Health, 17(24).
Al-Attas, S. A., Ibrahim, S. S., Amer, H. A., Darwish, Z. l.-S. and Hassan, M. H. (2014) ‘Prevalence of potentially malignant oral mucosal lesions among tobacco users in Jeddah, Saudi Arabia’, Asian Pac J Cancer Prev, 15(2), pp. 757-62.
Bouquot, J. E. and Ephros, H. (1995) ‘Erythroplakia: the dangerous red mucosa’, Pract Periodontics Aesthet Dent, 7(6), pp. 59-67; quiz 68.
Fatahzadeh, M. and Schwartz, R. A. (2013) ‘Oral Kaposi’s sarcoma: a review and update’, Int J Dermatol, 52(6), pp. 666-72.
Ferreira, A. M., de Souza Lucena, E. E., de Oliveira, T. C., da Silveira, É., de Oliveira, P. T. and de Lima, K. C. (2016) ‘Prevalence and factors associated with oral potentially malignant disorders in Brazil’s rural workers’, Oral Dis, 22(6), pp. 536-42.
Hashibe, M., Mathew, B., Kuruvilla, B., Thomas, G., Sankaranarayanan, R., Parkin, D. M. and Zhang, Z. F. (2000) ‘Chewing tobacco, alcohol, and the risk of erythroplakia’, Cancer Epidemiol Biomarkers Prev, 9(7), pp. 639-45.
Holmstrup, P. (2018) ‘Oral erythroplakia-What is it?’, Oral Dis, 24(1-2), pp. 138-143.
Holmstrup, P. and Pindborg, J. J. (1979) ‘Erythroplakic lesions in relation to oral lichen planus’, Acta Derm Venereol Suppl (Stockh), 59(85), pp. 77-84.
Iocca, O., Sollecito, T. P., Alawi, F., Weinstein, G. S., Newman, J. G., De Virgilio, A., Di Maio, P., Spriano, G., Pardiñas López, S. and Shanti, R. M. (2020) ‘Potentially malignant disorders of the oral cavity and oral dysplasia: A systematic review and meta-analysis of malignant transformation rate by subtype’, Head Neck, 42(3), pp. 539-555.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Kramer, I. R., Lucas, R. B., Pindborg, J. J. and Sobin, L. H. (1978) ‘Definition of leukoplakia and related lesions: an aid to studies on oral precancer’, Oral Surg Oral Med Oral Pathol, 46(4), pp. 518-39.
Lumerman, H., Freedman, P. and Kerpel, S. (1995) ‘Oral epithelial dysplasia and the development of invasive squamous cell carcinoma’, Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 79(3), pp. 321-9.
Mello, F. W., Miguel, A. F. P., Dutra, K. L., Porporatti, A. L., Warnakulasuriya, S., Guerra, E. N. S. and Rivero, E. R. C. (2018) ‘Prevalence of oral potentially malignant disorders: A systematic review and meta-analysis’, J Oral Pathol Med, 47(7), pp. 633-640.
MERRICKS, J. W. and COTTRELL, T. L. (1953) ‘Erythroplasia of Queyrat’, J Urol, 69(6), pp. 807-13.
Nielsen, H., Norrild, B., Vedtofte, P., Praetorius, F., Reibel, J. and Holmstrup, P. (1996) ‘Human papillomavirus in oral premalignant lesions’, Eur J Cancer B Oral Oncol, 32B(4), pp. 264-70.
O’Sullivan, E. M. (2011) ‘Prevalence of oral mucosal abnormalities in addiction treatment centre residents in Southern Ireland’, Oral Oncol, 47(5), pp. 395-9.
PINDBORG, J. J., RENSTRUP, G., POULSEN, H. E. and SILVERMAN, S. (1963) ‘STUDIES IN ORAL LEUKOPLAKIAS. V. CLINICAL AND HISTOLOGIC SIGNS OF MALIGNANCY’, Acta Odontol Scand, 21, pp. 407-14.
Reichart, P. A. and Philipsen, H. P. (2005) ‘Oral erythroplakia–a review’, Oral Oncol, 41(6), pp. 551-61.
Roza, A. L. O. C., Kowalski, L. P., William, W. N., de Castro, G., Chaves, A. L. F., Araújo, A. L. D., Ribeiro, A. C. P., Brandão, T. B., Lopes, M. A., Vargas, P. A., Santos-Silva, A. R. and Cancer, L. A. C. O. G. B. G. o. H. a. N. (2021) ‘Oral leukoplakia and erythroplakia in young patients: a systematic review’, Oral Surg Oral Med Oral Pathol Oral Radiol, 131(1), pp. 73-84.
Shafer, W. G. and Waldron, C. A. (1975) ‘Erythroplakia of the oral cavity’, Cancer, 36(3), pp. 1021-8.
Shear, M. (1972) ‘Erythroplakia of the mouth’, Int Dent J, 22(4), pp. 460-73.
Thavarajah, R., Rao, A., Raman, U., Rajasekaran, S. T., Joshua, E., R, H. and Kannan, R. (2006) ‘Oral lesions of 500 habitual psychoactive substance users in Chennai, India’, Arch Oral Biol, 51(6), pp. 512-9.
Villa, A., Villa, C. and Abati, S. (2011) ‘Oral cancer and oral erythroplakia: an update and implication for clinicians’, Aust Dent J, 56(3), pp. 253-6.
Warnakulasuriya, S. (2018) ‘Clinical features and presentation of oral potentially malignant disorders’, Oral Surg Oral Med Oral Pathol Oral Radiol, 125(6), pp. 582-590.
Yang, S. W., Lee, Y. S., Chang, L. C., Hsieh, T. Y. and Chen, T. A. (2015a) ‘Outcome of excision of oral erythroplakia’, Br J Oral Maxillofac Surg, 53(2), pp. 142-7.
Yang, S. W., Lee, Y. S., Chang, L. C., Hwang, C. C., Luo, C. M. and Chen, T. A. (2015b) ‘Clinical characteristics of narrow-band imaging of oral erythroplakia and its correlation with pathology’, BMC Cancer, 15, pp. 406.
Zaini, Z. M., McParland, H., Møller, H., Husband, K. and Odell, E. W. (2018) ‘Predicting malignant progression in clinically high-risk lesions by DNA ploidy analysis and dysplasia grading’, Sci Rep, 8(1), pp. 15874.







