La fibrose orale sous-muqueuse (FOSM) est une affection cicatricielle chronique et progressive qui touche la muqueuse oropharyngée et, souvent, la partie supérieure de l’œsophage.
Il n’existe pas de définition universellement acceptée de la FOSM, et les définitions plus récentes visent à fournir des informations sur l’étiologie, l’épidémiologie et les caractéristiques cliniques de la maladie. En 1966, Pindborg a défini la FOSM comme « une maladie insidieuse et chronique qui affecte n’importe quelle partie de la cavité buccale et parfois le pharynx ». Brad (2019) a défini la FOSM comme une « affection chronique, précancéreuse et souvent invalidante, caractérisée par une fibrose lentement progressive de la cavité buccale et de l’oropharynx » et Langdon (2007) a décrit la FOSM comme « une maladie progressive dans laquelle des bandes fibreuses se forment sous la muqueuse buccale ».
Étiopathogénie
L’étiologie de la FOSM est multifactorielle..
- L’Areca ou noix de bétel est le nom de la noix provenant de la plante Areca.
- Une relation dose-dépendante pour la fréquence et la durée de mastication a été constatée dans le développement de la FOSM.
- La mastication de l’arec, du bétel ou du paan est une habitude récréative courante dans le sous-continent indien et sa consommation devient de plus en plus courante dans les communautés occidentales en raison des migrations.
- Certaines préparations de noix d’Areca contiennent du tabac et d’autres substances cancérigènes connues. La noix d’Areca prise isolément est un cancérogène reconnu, car elle contient certains tannins et alcaloïdes, qui ont une cytotoxicité et une génotoxicité. La chaux éteinte, qui est un autre ingrédient courant des préparations à base de noix d’arec, présente des concentrations élevées d’arsenic.
- Dans la religion hindoue, la noix d’Areca est considérée comme divine et elle est consommée en raison de sa valeur médicinale. Elle a également été perçue comme un aphrodisiaque, un agent qui améliore l’hygiène buccale et réduit l’halitose, un stimulant salivaire qui améliore la digestion et, dans le sous-continent indien, elle est réputée pour avoir un effet stabilisateur sur le contrôle de la glycémie chez les patients diabétiques.
- L’arecoline, un sous-produit du métabolisme de la noix d’arec, est un alcaloïde qui traverse facilement la barrière hémato-encéphalique et a été impliqué dans le risque de dépendance lié à la mastication de la noix d’arec. Les effets physiologiques qui en découlent sont souvent décrits comme euphoriques, les utilisateurs décrivent également une conscience accrue et une meilleure productivité.
- La mastication de la noix d’arec a été impliquée comme facteur étiologique dans le développement de la FOSM. Le Centre international de recherche sur le cancer a classé la noix d’arec dans le groupe 1 des agents cancérigènes.
- Parmi les autres facteurs étiologiques signalés figurent: la consommation de tabac (sans fumée), des carences hématologiques, l’anémie et la malnutrition.
- Il peut également exister une prédisposition génétique, avec une association avec certains sous-types et haplotypes HLA (A10/DR3).
- La malnutrition, l’anémie et les carences hématologiques sont associées à une atrophie de la muqueuse buccale et à un potentiel accru de synthèse du collagène.
La mastication de la noix d’arec est le principal facteur de risque étiologique dans le développement de la FOSM et les facteurs ci-dessus peuvent être considérés comme des facteurs contributifs.
Histopathologie
- La FOSM se caractérise un dépôt anormal de collagène.
- Les alcaloïdes de l’arec, comme l’arecoline, provoquent la prolifération des fibroblastes. Les arômes contenus dans les préparations à base de noix d’arec, tels que les tanins, peuvent également inhiber l’activité de la collagénase.
- La progression de la maladie est associée au remplacement du collagène de type 1, facilement dégradable, par du collagène de type 3, plus résistant. On observe également une inhibition de la phagocytose du collagène.
- Les prélèvements histopathologiques présentent certaines caractéristiques de la FOSM, telles que l’atrophie ou l’amincissement de l’épithélium, une hyalinisation juxta-épithéliale et du collagène de densité variable, ainsi qu’une lamina propria fibrosée et des fibrilles d’ancrage.
Épidemiologie
La FOSM est surtout présente dans le sous-continent indien et en Asie du Sud-Est, notamment en Inde, à Taïwan, en Chine, au Bangladesh, en Malaisie, à Singapour, en Thaïlande et au Sri Lanka. Elle a également été rapportée en Afrique du Sud et en Arabie saoudite. La FOSM est présente dans les populations asiatiques aux Etats-Unis, au Royaume-Uni et dans les pays développés, et cette maladie représente donc un fardeau sanitaire mondial. Le nombre de cas dans le monde en 1996 a été estimé à 2,5 millions. La prévalence en Inde a été estimée à 30%. La consommation de noix d’Areca dans le monde est estimée à 5-20%. Les symptômes de la FOSM ont tendance à se développer dans la 4e ou 5e décennie de la vie, mais des cas ont été signalés chez des patients bien plus jeunes âgés de onze ans. La maladie a une prépondérance féminine pour des raisons inconnues.
Manifestation clinique
- La FOSM a été cliniquement classée en quatre stades par More (2012), englobant une phase éruptive puis une phase fibrotique.
- La phase éruptive peut être associée à la formation de vésicules, une sensation de brûlure et un inconfort dans la cavité buccale sont fréquents. La texture de la muqueuse buccale commence à changer, perdant sa souplesse. La dépigmentation de la muqueuse progresse, et la muqueuse commence à blanchir. Une pétéchie de la muqueuse peut se développer, ainsi qu’une pigmentation mélanotique de la muqueuse, une ulcération de la muqueuse et des zones érythémateuses.
- Au deuxième stade, une fibrose se développe en regard des vésicules et les ulcérations lorsqu’elles guérissent. Des bandes fibreuses verticales et circulaires palpables dans la muqueuse buccale et/ou l’oropharynx se développent avec ou sans stomatite. Des bandes plus fines peuvent être présentes dans les stades précoces par rapport à ces bandes palpables.
- Au stade trois, des bandes fibreuses palpables peuvent être présentes dans n’importe quelle partie de la cavité buccale, avec ou sans stomatite. Le stade quatre regroupe toutes les manifestations précédentes ainsi que le développement d’une affection potentiellement maligne ou d’un carcinome épidermoïde oral.
- Les signes spécifiques des stades deux à quatre sont le trismus, la dépigmentation de la gencive, la luette atrophiée et la dépapillation de la langue. Des changements dans l’esthétique du visage peuvent également être observés avec un affaissement des joues qui n’est pas corrélé à l’âge ou à l’état nutritionnel.
- Dans les cas graves, des déficits de la parole et de l’audition peuvent se développer. Il a été rapporté que la FOSM a un impact significatif sur la qualité de vie dans les stades les plus avancés.
- Il a également été décrit une classification fonctionnelle de la FOSM basée sur l’ouverture buccale inter-incisive : stade 1 (supérieur ou égal à 35 mm), stade 2 (entre 25 et 35 mm), stade 3 (15 et 25 mm) et stade 4 (moins de 15 mm).
- En 1956, Paymaster a été le premier à signaler le potentiel de transformation maligne de cette affection.
- Il existe des variations géographiques significatives dans les taux de transformation maligne rapportés. Le taux est généralement plus élevé en Inde, par rapport aux autres pays.
- Cela pourrait s’expliquer par la façon dont la noix d’arec est préparée et l’ajout de certains additifs. Des études taïwanaises ont montré que les produits du tabac ne sont généralement pas utilisés en même temps que les produits à base de noix d’arec, ce qui pourrait expliquer le taux plus faible de transformation maligne dans cette population.
- Le taux de transformation maligne a été estimé entre 1 et 9%.
- Un taux de transformation maligne plus élevé a été observé chez les personnes présentant une leucoplasie orale concomitante.
- Les cancers buccaux se développant à partir de la FOSM sont à la fois moins et plus agressifs que les cancers buccaux provenant d’autres lésions de la cavité buccale.
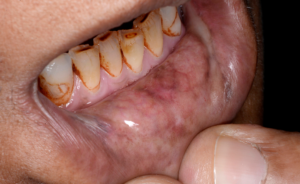
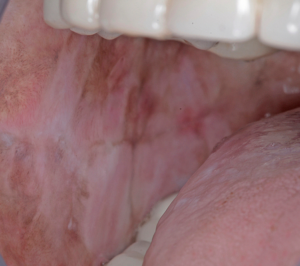
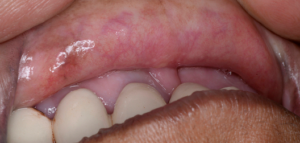
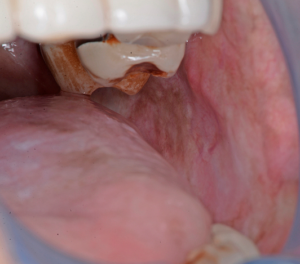
Diagnostic Differentiel
Dans les premiers stades, la FOSM peut être mal diagnostiquée. Les patients se plaignant d’une sensation de brûlure avec atrophie de la muqueuse peuvent être diagnostiqués comme souffrant de dysesthésie orale, avec ou sans facteur contributif sous-jacent tel qu’une carence en hémoglobine ou une anémie. Une anamnèse minutieuse et une enquête sur les habitudes récréatives sont fondamentales. La FOSM peut présenter des caractéristiques similaires à d’autres affections à potentiel malin de la muqueuse buccale, comme le lichen plan buccal.
La sclérodermie est une maladie auto-immune qui touche la peau, les organes internes et les vaisseaux sanguins. Elle se caractérise par une sclérose diffuse de la peau et des autres tissus conjonctifs. La sclérodermie peut se manifester par des bandes fibreuses dans la muqueuse buccale et un trismus progressif. Les patients atteints de sclérodermie ont également des plaintes extra-buccales. L’imagerie microvasculaire et la recherche d’auto-anticorps aident à établir le diagnostic de la sclérodermie.
L’amylose se caractérise par le dépôt de protéines amyloïdes (protéines fibrillaires) dans les tissus. L’amylose systémique peut se manifester par une macroglossie ou un trismus progressif. Une anamnèse minutieuse, une prise de sang et une biopsie permettent d’établir le diagnostic.
À un stade plus avancé, la FOSM peut se présenter sous la forme d’un carcinome epidermoïde oral, d’une leucoplasie et d’une érythroplasie.
Diagnostic
- Un interrogatoire minutieux concernant les habitudes de consommation récréative suggère fortement un diagnostic d’OSMF. La FOSM étant une affection à potentiel malin, des biopsies sont nécessaires.
- L’analyse histopathologique est utile pour la classification du stade clinique de la maladie, dans laquelle la distribution et le nombre de fibroblastes, de fibres de collagène, la présence et le nombre de cellules inflammatoires et de vaisseaux sanguins sont corrélés avec la classification de la maladie.
- Le traumatisme crée par la biopsie induit un certain degré de fibrose qui peut contribuer à l’aggravation du trismus.
- Certains biomarqueurs, tels que l’ARNm, peuvent influencer le stade de la maladie et l’analyse génétique des spécimens peut prédire une future transformation maligne.
- L’hématoxyline et l’éosine sont les colorations les plus couramment utilisées pour le diagnostic de la FOSM.
Prise en charge
Les patients doivent être sensibilisés aux risques liés à la la mastication de la noix d’Areca, à son rôle dans l’étiopathogénie et le risque de transformation maligne. Il convient de les encourager à cesser cette habitude. La FOSM représente une charge de morbidité mondiale importante et la prévention primaire est un élément clé de la stratégie gouvernementale dans les pays du sous-continent indien. Des approches telles que l’interdiction des produits de la plante Areca et de leurs préparations, ainsi que l’éducation sur les effets nocifs de la mastication de la noix d’Areca, se sont avérées utiles pour la prévention primaire, tant au niveau individuel que de la population. La FOSM se présente souvent tardivement, créant un dilemme de gestion.
» Traitement conservateur
Traitement conservateur
- Aux stades modérés à sévères de la FOSM, le degré de fibrose est irréversible, et le traitement est principalement symptomatique.
- Le traitement conservateur de la réduction progressive de l’amplitude de l’ouverture buccale repose sur la physiothérapie. Divers exercices visant à étirer les tissus et à renforcer les muscles de la mastication sont conseillés. Des dispositifs sur mesure peuvent également être utiles pour réduire le trismus. Les patients sont encouragés à masser les muscles de la mastication. L’hygiène bucco-dentaire doit être renforcée car les patients atteints de FOSM présentent des niveaux plus élevés de maladies dentaires telles que les maladies parodontales, les caries dentaires et l’halitose.
- Un anesthésique local peut être prescrit pour les patients se plaignant d’une gêne buccale. Dans les stades plus avancés de FOSM, des injections intralésionnelles de corticostéroïdes ont été efficaces pour réduire le trismus.
» View less
» Traitement chirurgical
Traitement chirurgical
- Un traitement chirurgical peut être indiqué dans les cas de trismus sévère visant à améliorer l’ouverture buccale.
- L’approche chirurgicale consiste généralement à retirer le tissu fibrosé et les soins postopératoires visent à maintenir l’ouverture obtenu après la libération musculaire.
- La simple excision des bandes fibrosées aggrave la pathologie, car le traumatisme iatrogène du processus chirurgical entraîne une fibrose ultérieure.
- Le trismus chronique résultant de la FOSM peut entraîner des changements physiologiques dans le tendon temporal. Des procédures de greffe de peau peuvent aider à résoudre ce problème, par exemple une greffe de peau d’épaisseur variable après une myotomie temporale bilatérale ou une coronoïdectomie. Il s’agit d’interventions chirurgicales importantes qui ne doivent pas être entreprises à la légère, mais qui peuvent soulager les symptômes du trismus.
- La myotomie d’autres muscles masticateurs peut également être envisagée.
» View less
Résumé
Le trismus chronique résultant de l’OSMF peut entraîner des changements physiologiques dans le tendon temporal et des procédures de greffe de peau peuvent aider à résoudre ce problème, par exemple une greffe de peau d’épaisseur partielle après une myotomie temporale bilatérale ou une coronoïdectomie. Il s’agit d’interventions chirurgicales importantes qui ne doivent pas être entreprises à la légère, mais qui peuvent soulager les symptômes du trismus.
Dans le monde entier, la population générale et les professionnels de la santé connaissent mal cette maladie. Cela peut contribuer à la prise en charge tardive de ces patients. Tous les professionnels de santé ont un rôle à jouer dans la prévention primaire et la reconnaissance de cette maladie.
Références et Lectures Complémentaires
J.D. Langdon, in Oral and Maxillofacial Surgery (Second Edition), 2007
Brad W. Neville DDS, … Angela C. Chi DMD, in Color Atlas of Oral and Maxillofacial Diseases, 2019
Raman Bedi, Crispian Scully, in Manson’s Tropical Infectious Diseases (Twenty-third Edition), 2014
More C, Gupta S, Joshi J, Varma S. Classification system of Oral submucous fibrosis. J Indian Acad Oral Med Radiol. 2012;24(1):24–9
Ali, F. M., Patil, A., Patil, K. and Prasant, M. C. (2014) ‘Oral submucous fibrosis and its dermatological relation’, Indian Dermatol Online J, 5(3), pp. 260-5.
Angadi, P. V. and Rao, S. S. (2011) ‘Areca nut in pathogenesis of oral submucous fibrosis: revisited’, Oral Maxillofac Surg, 15(1), pp. 1-9.
Arakeri, G., Patil, S. G., Aljabab, A. S., Lin, K. C., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017a) ‘Oral submucous fibrosis: An update on pathophysiology of malignant transformation’, J Oral Pathol Med, 46(6), pp. 413-417.
Arakeri, G., Rai, K. K., Boraks, G., Patil, S. G., Aljabab, A. S., Merkx, M. A. W., Carrozzo, M. and Brennan, P. A. (2017b) ‘Current protocols in the management of oral submucous fibrosis: An update’, J Oral Pathol Med, 46(6), pp. 418-423.
Arakeri, G., Rai, K. K., Hunasgi, S., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017c) ‘Oral submucous fibrosis: An update on current theories of pathogenesis’, J Oral Pathol Med, 46(6), pp. 406-412.
Cox, S. C. and Walker, D. M. (1996) ‘Oral submucous fibrosis. A review’, Aust Dent J, 41(5), pp. 294-9.
Garg, A., Chaturvedi, P. and Gupta, P. C. (2014) ‘A review of the systemic adverse effects of areca nut or betel nut’, Indian J Med Paediatr Oncol, 35(1), pp. 3-9.
Gupta, P. C. and Warnakulasuriya, S. (2002) ‘Global epidemiology of areca nut usage’, Addict Biol, 7(1), pp. 77-83.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Murti, P. R., Bhonsle, R. B., Pindborg, J. J., Daftary, D. K., Gupta, P. C. and Mehta, F. S. (1985) ‘Malignant transformation rate in oral submucous fibrosis over a 17-year period’, Community Dent Oral Epidemiol, 13(6), pp. 340-1.
Pandya, S., Chaudhary, A. K., Singh, M. and Mehrotra, R. (2009) ‘Correlation of histopathological diagnosis with habits and clinical findings in oral submucous fibrosis’, Head Neck Oncol, 1, pp. 10.
Passi, D., Bhanot, P., Kacker, D., Chahal, D., Atri, M. and Panwar, Y. (2017) ‘Oral submucous fibrosis: Newer proposed classification with critical updates in pathogenesis and management strategies’, Natl J Maxillofac Surg, 8(2), pp. 89-94.
PAYMASTER, J. C. (1956) ‘Cancer of the buccal mucosa; a clinical study of 650 cases in Indian patients’, Cancer, 9(3), pp. 431-5.
Pindborg, J. J. and Sirsat, S. M. (1966) ‘Oral submucous fibrosis’, Oral Surg Oral Med Oral Pathol, 22(6), pp. 764-79.
Rai, A., Ahmad, T., Parveen, S., Faizan, M. I. and Ali, S. (2020) ‘Expression of transforming growth factor beta in oral submucous fibrosis’, J Oral Biol Craniofac Res, 10(2), pp. 166-170.
Rai, S., Rattan, V., Gupta, A. and Kumar, P. (2018) ‘Conservative management of Oral Submucous Fibrosis in early and intermediate stage’, J Oral Biol Craniofac Res, 8(2), pp. 86-88.
Rajendran, R. (1994) ‘Oral submucous fibrosis: etiology, pathogenesis, and future research’, Bull World Health Organ, 72(6), pp. 985-96.
Rao, N. R., Villa, A., More, C. B., Jayasinghe, R. D., Kerr, A. R. and Johnson, N. W. (2020) ‘Oral submucous fibrosis: a contemporary narrative review with a proposed inter-professional approach for an early diagnosis and clinical management’, J Otolaryngol Head Neck Surg, 49(1), pp. 3.
Shih, Y. H., Wang, T. H., Shieh, T. M. and Tseng, Y. H. (2019) ‘Oral Submucous Fibrosis: A Review on Etiopathogenesis, Diagnosis, and Therapy’, Int J Mol Sci, 20(12).
Silva, W. P., Wastner, B. F., Bohn, J. C., Jung, J. E., Schussel, J. L. and Sassi, L. M. (2015) ‘Unusual presentation of oral amyloidosis’, Contemp Clin Dent, 6(Suppl 1), pp. S282-4.
Yoithapprabhunath, T. R., Maheswaran, T., Dineshshankar, J., Anusushanth, A., Sindhuja, P. and Sitra, G. (2013) ‘Pathogenesis and therapeutic intervention of oral submucous fibrosis’, J Pharm Bioallied Sci, 5(Suppl 1), pp. S85-8.







