Le lupus érythémateux discoïde (LED) est une affection inflammatoire chronique qui touche la peau et la muqueuse buccale. Le DLE est la variante la plus courante du lupus cutané chronique et représente 80 % des cas. La physiopathologie de la maladie est complexe et fait intervenir de multiples facteurs, notamment la génétique, les facteurs environnementaux et le système immunitaire inné et adaptatif. Les déclencheurs environnementaux les plus courants du LED sont les rayons UV, les médicaments, la radiothérapie et le tabac.
- La prévalence du LED varie de 9 à 70 cas pour 100 000 habitants.
- L’incidence du DLE est 3 à 5 fois plus élevée dans les groupes ethniques asiatiques et noirs que dans les groupes ethniques blancs.
- Il touche principalement les femmes, avec un rapport femmes/hommes de 3:1.
- Il se développe le plus souvent chez les personnes âgées de 20 à 40 ans.
- Les lésions buccales sont présentes chez 20 % des patients atteints de LED.
- L’apparition de lésions buccales chez les patients atteints de LED sans atteinte cutanée est rare et signalée dans 10 % des cas.
[/basculer]
- La présentation la plus commune du lupus cutané chronique est le LED, qui peut être localisé (80 % des cas) avec des lésions sur le visage, les oreilles et le cuir chevelu.
- Le LED disséminé (20 % des cas) présente des lésions au-dessus et au-dessous du cou et est associé à un risque accru de progression vers un lupus érythémateux systémique.
Lésions Cutanées:
- Les lésions cutanées du LED se présentent sur les zones exposées au soleil du visage et du cou avec un érythème annulaire et une hyperkératose folliculaire. Une plaque caractéristique sur la zone malaire du visage et l’arête du nez en forme de papillon a été décrite.
- Les lésions cutanées peuvent être accompagnées d’une sensation de démangeaison ou de brûlure.
- Au fur et à mesure de l’évolution des lésions cutanées, on observe une atrophie centrale, des cicatrices, des télangiectasies et une hypopigmentation. Une alopécie cicatricielle irréversible du cuir chevelu se produit également.
Lésions buccales:
- Les lésions buccales sont présentes dans environ 20 % des cas et touchent généralement les lèvres, le palais dur et la muqueuse buccale.
- Les lésions buccales de LED se caractérisent par la présence d’un érythème ou d’une ulcération centrale entourée de papules hyperkératosiques ou de stries rayonnantes, et de télangiectasies périphériques (Figures 1 et 2). L’aspect en » nid d’abeille » apparaît dans les lésions de longue date.
- Les lésions muqueuses peuvent survenir sans atteinte de la peau ou avant le développement de lésions cutanées. Les lésions des lèvres peuvent s’étendre à la peau adjacente et masquer le bord du vermillon.
- Une gingivite desquamative affectant la gencive inférieure et/ou supérieure peut également être présente.
- Avec la guérison, les lésions érosives peuvent laisser une pigmentation post-inflammatoire.
- Les symptômes les plus courants du LED sont une sensation de brûlure, la photosensibilité, la sécheresse, la sensibilité et la douleur, mais les lésions peuvent être asymptomatiques.
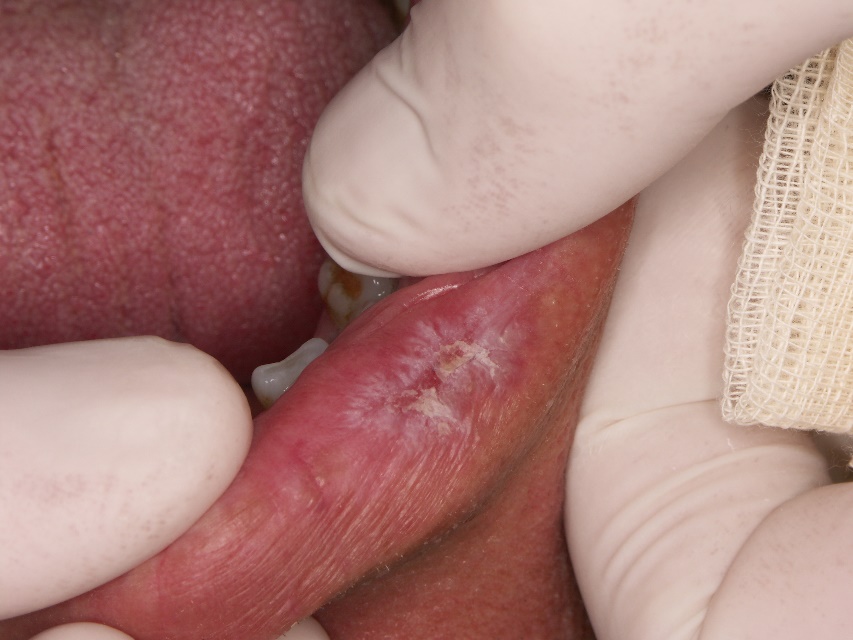
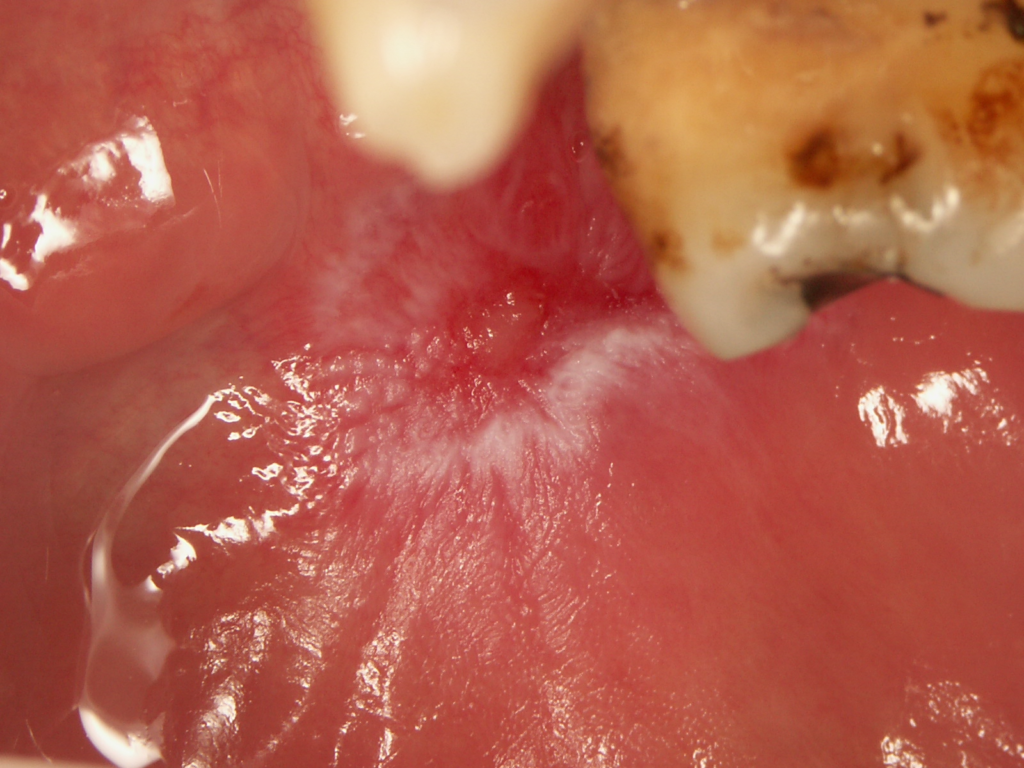
- Les patients atteints de LED présentent un risque accru de cancer, notamment de cancer de la peau sans mélanome et de cancer de la bouche, par rapport à la population générale.
- L’Organisation mondiale de la santé a classé le LED dans la catégorie des lésions à potentiel malin, bien que la transformation maligne soit rare.
- Le plus souvent, une transformation maligne se produit dans les lésions de LED localisées sur le bord vermillon de la lèvre, la lèvre inférieure étant plus souvent touchée.
- L’exposition prolongée aux rayons ultraviolets, les cicatrices chroniques, l’infection par le HVP et les traitements immunosuppresseurs à long terme peuvent être des facteurs prédisposant au développement de carcinome epidermoïde. La durée moyenne entre l’apparition du LED et le développement d’un cancer de la lèvre est plus courte que celle des cancers provenant de lésions de LED sur d’autres sites (10-13 ans contre 19-26 ans).
- Les cancers liés aux LED sont plus agressifs et ont un potentiel métastatique (10-25%), des taux de récidive (27-29%) et une mortalité (19,4%) plus élevés que les cancers non liés aux LED (20%, 0,5-6% et 1%, respectivement).
[/basculer]
Le diagnostic différentiel des lésions buccales de LED comprend le lichen plan buccal, les réactions lichénoïdes, la leucoplasie buccale et la chéilite actinique (lorsque la lèvre inférieure est touchée).
Dans le cas du lichen plan oral, les lésions sont plus étendues et distribuées de manière plus symétrique, et le motif réticulaire est plus prononcé contrairement aux lésions buccales du LED.
Les réactions lichénoïdes se présentent sous forme de stries blanches dans les sites directement en contact avec la restauration en amalgame. Après le retrait de la restauration, la lésion s’améliore ou disparaît.
La leucoplasie orale ne présente pas de motif en stries hyperkératosiques radiales et ne présente pas d’atrophie centrale.
La chéilite actinique concerne généralement la lèvre inférieure et se présente sous forme de croûtes sans formation de stries.
[/basculer]
- Le diagnostic du LED peut être difficile à établir compte tenu des similitudes avec le lichen plan buccal sur le plan histopathologique.
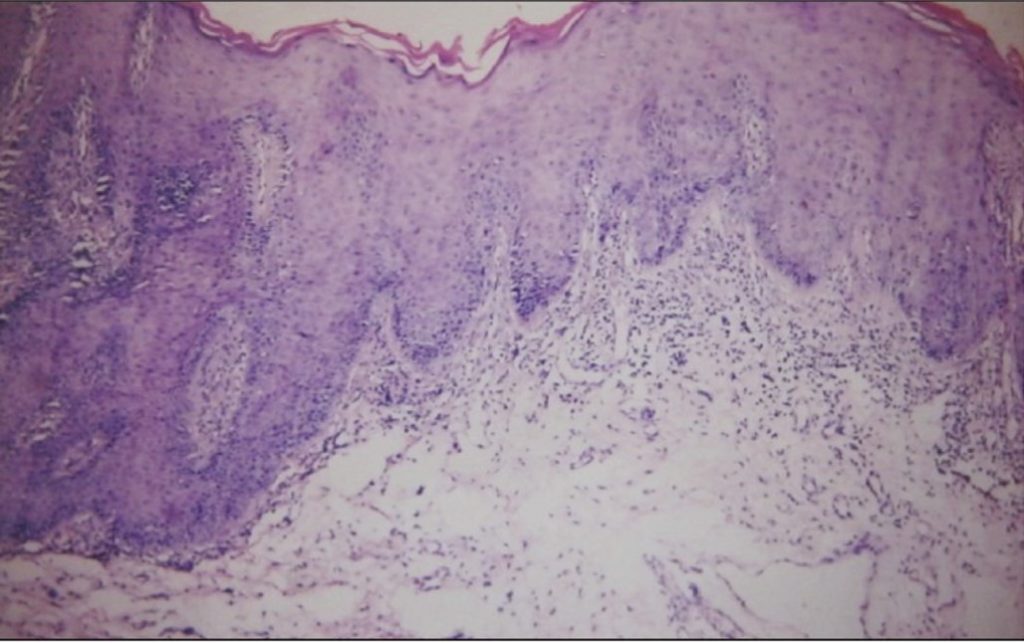
- Les résultats histologiques du LED oral comprennent une hyperkératose, une atrophie des crêtes de rete, une dégénérescence hydropique de la couche basale, une mucosité d’interface avec un infiltrat lymphocytaire périvasculaire superficiel ou profond, un œdème dans la lamina propria et un épaississement PAS positif des parois des vaisseaux sanguins (Figure 3).
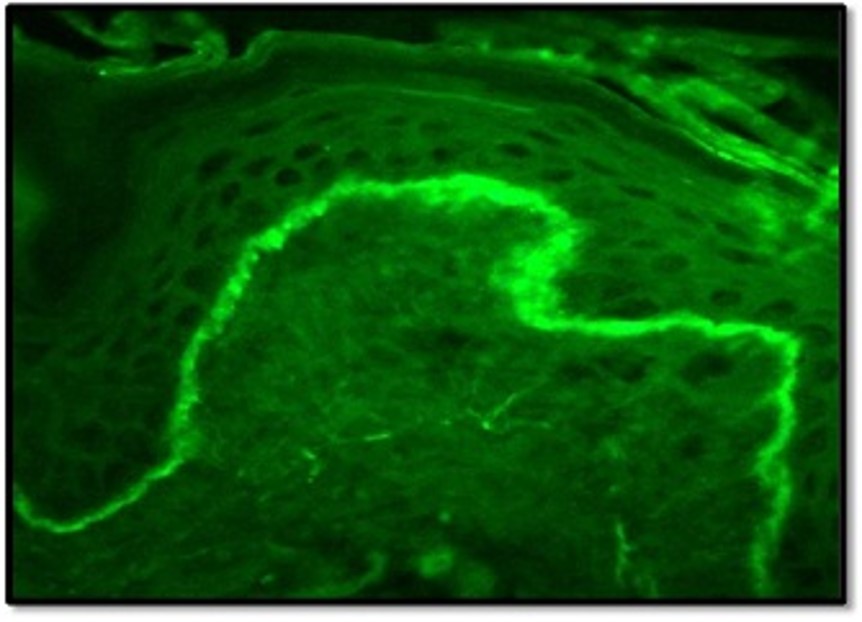
- L’immunofluorescence directe (IFD) peut être utile pour une analyse plus approfondie. Les lésions de LED montrent un dépôt linéaire ou granulaire d’IgM, d’IgG et du complément 3 (C3) au niveau de la zone de la membrane basale – la « bande lupique » (Figure 4).
- Contrairement au LED, des dépôts de fibrinogène peuvent être trouvés chez 90 à 100 % des patients atteints de lichen plan oral le long de la membrane basale. En raison de la différence marquée des résultats de l’IFD entre le DLE et le lichen plan buccal, de nombreux auteurs estiment que l’IFD devrait faire partie de la norme diagnostique en cas de suspicion.
- Des anomalies sérologiques et hématologiques peuvent être détectées chez les patients atteints de DLE. Dans certains cas, la vitesse de sédimentation des érythrocytes peut être élevée. Environ 20 % des patients ont des anticorps antinucléaire positifs et jusqu’à 20 % ont des auto-anticorps anti-Sm. Les auto-anticorps anti-Sm, généralement observés dans le lupus érythémateux systémique, peuvent être présents chez 5 à 20 % des patients atteints de LED.
[/basculer]
- Les patients doivent être informés de la possibilité d’évolution vers une maladie systémique. Le risque de progression du LED vers une forme systémique est de 16,7% dans les 3 ans suivant le diagnostic et de 17% dans les 8 ans suivant le diagnostic. Les mesures préventives comprennent l’évitement de l’exposition aux UV et l’arrêt du tabac.
- L’utilisation de la crème topique de fluocinonide, de l’hydroxychloroquine systémique et de l’acitrétine chez les patients atteints de DLE affectant la peau a fait ses preuves. Il y a peu d’éléments pour les utiliser dans la prise en charge orale du LED .
Lésions buccales localisées:
- Le traitement topique est le traitement de première intention. Les corticostéroïdes topiques (acétonide de triamcinolone, valérate de bétaméthasone, diproprionate de clobétasol, hydrocortisone, acétonide de fluocinolone) sont le pilier du traitement.
- Les inhibiteurs de la calcineurine (tacrolimus, pimecrolimus) peuvent également être utilisés.
- L’injection intralésionnelle de corticostéroïdes (acétonide de triamcinolone) est utile pour les lésions isolées.
Lésions récalcitrantes ou étendues
- Un traitement systémique est souvent nécessaire. Par exemple, les antipaludéens (hydroxychloroquine, chloroquine et quinacrine), seuls ou en association avec des corticostéroïdes systémiques, sont utilisés comme médicaments systémiques de première intention.
- Dans les cas plus graves, des immunomodulateurs (dapsone, thalidomide, lenalidomide) et/ou des rétinoïdes oraux (acitretin, isotretinoin, alitretinoin) et/oudes immunosuppresseurs (methotrexate, azathioprine, cyclophosphamide, mycophenolate mofetil, mycophenolate sodium, cyclosporine) peuvent être utilisés.
- Les biothérapies (rituximab, belimumab) sont utilisés dans les cas les plus graves.
Les patients atteints de LED doivent être suivis à intervalles réguliers. La réponse au traitement diffère d’un patient à l’autre, pouvant aller de quelques semaines à plusieurs mois. Chaque patient doit être pris en charge au cas par cas dans le but de contrôler les symptômes et de surveiller une éventuelle transformation maligne.
[/basculer]
Warnakulasurya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:582–90.
Stannard JN, Kahlenberg JN. Cutaneous lupus erythematosus: updates on pathogenesis and associations with systemic lupus. Curr Opin Rheumatol. 2016;28(5): 453–9.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Cutaneous lupus erythematosus and the association with systemic lupus erythematosus: a population-based cohort of 1088 patients in Sweden. Br J Dermatol. 2011;164(6):1335-41.
Blake SC, Daniel BS. Cutaneous lupus erythematosus: A review of the literature. Int J Womens Dermatol. 2019;5(5):320-9.
Szczęch J, Samotij D, Werth DP, Reich A. Trigger factors of cutaneous lupus erythematosus: a review of current literature. Lupus. 2017;26(8):791-807.
Izmirly PM, Buyon JP, Belmont HM, Sahl S, Wan I, Salmon JE et al. Population-based prevalence and incidence estimates of primary discoid lupus erythematosus from the Manhattan Lupus Surveillance Program. Lupus Sci Med. 2019;6(1):e000344.
Jarukitsopa S, Hoganson DDD, Crowson CS, Sokumbi O, Davis MD, Michet CJ et al. Epidemiology of Systemic Lupus Erythematosus and Cutaneous Lupus in a Predominantly White Population in the United States. Arthritis Care Res. 2015; 67(6): 817–28.
Drenkard C, Parker S, Aspey LD, Gordon C, Helmick CG, Bao G, Sam Lim S. Racial disparities in the incidence of primary chronic cutaneous lupus erythematosus in the southeastern US: the Georgia lupus registry. Arthritis Care Res. 2019; 71:95–103.
Nico MMS, Apparecida M, Vileila C, Rivitti EA, Lourenco SV. Oral lesions in lupus erythematosus: correlation with cutaneous lesions. Eur J Dermatol 2008;18(4):376-81.
Menzies S, O’Shea F, Galvin S, Wynne B. Oral manifestations of lupus. Ir J Med Sci. 2018; 187:91–3.
Ranginwala AM, Chalishazar MM, Panja P, Buddhdev KP, Kale HM. Oral discoid lupus erythematosus: A study of twenty-one cases. J Oral Maxillofac Pathol. 2012;16(3): 368–73.
Lallas A, Apalla Z, Lefaki I, et al. Dermoscopy of discoid lupus erythematosus. Br J Dermatol 2013;168: 284–8.
McDaniel B, Sukumaran S,Tanner LS. Discoid Lupus Erythematosus. NCBI Bookshelf. A service of the National Library of Medicine, National Institutes of Health. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-.
Shafer WG, Hine MK, Levy BM. A textbook of oral pathology. 7th ed. Philadelphia: W B Saunders;1999. p. 8992.
Kranti K, Seshan H, Juliet J. Discoid lupus erythematosus involving gingiva. J Indian Soc Periodontol. 2012;16(1): 126–8.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Increased risk of cancer among 3663 patients with cutaneous lupus erythematosus: A Swedish nationwide cohort study. Br J Dermatol 2012; 166: 1053–1059.
de Berker D, Dissaneyeka M, Burge S. The sequelae of chronic cutaneous lupus erythematosus. Lupus 1992;1:181-6.
Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-580.
Arvanitidou IE, Nikitakis NG, Georgaki M, Papadogeorgakis N, Tzioufas A, Sklavounou A. Multiple primary squamous cell carcinomas of the lower lip and tongue arising in discoid lupus erythematosus: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:e22-e30.
Fernandes MS, Girisha BS, Viswanathan N, Sripathi H and Noronha TM. Discoid lupus erythematosus with squamous cell carcinoma: a case report and review of the literature in Indian patients. Lupus. 2015; 24: 1562–6.
Sherman RN, Lee CW, Flynn KJ. Cutaneous squamous cell carcinoma in black patients with chronic discoid lupus erythematosus. Int J Dermatol 1993; 32: 677–679.
Liu W, Shen ZY, Wang LJ, et al. Malignant potential of oral and labial chronic discoid lupus erythematosus: A clinicopathological study of 87 cases. Histopathology 2011; 59: 292–298.
Tao J, Zhang X, Guo N, et al. Squamous cell carcinoma complicating discoid lupus erythematosus in Chinese patients: Review of the literature, 1964–2010. J Am Dermatol 2012; 66: 695–696.
Makita E, Akasaka E, Sakuraba Y, Korekawa A, Aizu T, Kaneko T et al. Squamous cell carcinoma on the lip arising from discoid lupus erythematosus: a case report and review of Japanese patients. Eur J Dermatol. 2016;26(4):395-6.
Naik V, Prakash S. Oral Discoid Lupus Erythematosus: A Case Effectively Managed and Differentiated with other Overlapping Diseases. Indian J Dent Adv 2018;9(4): 221-5.
Del Barrio‐Díaz P, Reyes‐Vivanco C, Cifuentes‐Mutinelli M, Manríquez J, Vera‐Kellet C. Association between oral lesions and disease activity in lupus erythematosus. J Eur Acad Dermatol Venereol. 2020;34(2):349-356.
Martins da Costa Marques ER, Silva R, Hsieh R. Oral Mucosal Manifestation of Lupus Erythematosus: A Short Review. DOBCR. doi: 10.31487/j.DOBCR.2020.02.09
Bhushan R, Agarwal S, Chander R, Agarwal K. Direct Immunofluorescence Study in Discoid Lupus Erythematosus. World Journal of Pathology 2017; 9:56-60.
Biazar C. Sigges J. Patsinakidis N. Ruland V. Amler S. Bonsmann G. Kuhn A. Cutaneous lupus erythematosus: first multicenter database analysis of 1002 patients from the European Society of Cutaneous Lupus Erythematosus (EUSCLE).Autoimmun Rev. 2013; 12(3):444-454.
Wieczorek I.T., Propert K.J., Okawa J, Werth V.P. Systemic symptoms in the progression of cutaneous to systemic lupus erythematosus. JAMA Dermatol. 2014; 150(3):291-6.
Jessop S, Whitelaw DA, Grainge MJ, Jayasekera P. Drugs for discoid lupus erythematosus. Cochrane Database Syst Rev. 2017;5(5):CD002954.
Okon LG, Werth VP. Cutaneous lupus erythematosus: diagnosis and treatment. Best Pract Res Clin Rheumatol. 2013;27: 391-404.
[/basculer]







