O Lúpus Eritematoso Discoide (LED) é uma condição inflamatória crónica que afeta a pele e a mucosa oral. É a variante mais comum do lúpus cutâneo crónico, compreendendo 80% dos casos. A fisiopatologia da doença é complexa e envolve múltiplos fatores incluindo os de ordem genética, ambientais e os sistemas imunológicos inato e adaptativo. As causas ambientais mais comuns da doença incluem exposição à radiação UV, fármacos, radioterapia e hábitos tabágicos.
Epidemiologia
- A prevalência de LED varia entre 9 a 70 casos por 100 000 habitantes.
- A incidência de LED é 3 a 5 vezes maior em grupos étnicos asiáticos e africanos em comparação com grupos étnicos caucasianos.
- Afeta predominantemente indivíduos do sexo feminino com uma proporção de mulheres para homens de 3:1.
- Desenvolve-se maioritariamente em pessoas com idades compreendidas entre os 20 e os 40 anos.
- Verificam-se lesões orais em 20% dos pacientes com LED.
- A ocorrência de lesões orais em pacientes com LED sem envolvimento cutâneo é rara e relatada em 10% dos casos
Manifestações Clínicas
- A manifestação mais comum do lúpus cutâneo crónico é o LED, que pode ocorrer como tipo localizado (80%) com lesões na face, orelhas e couro cabeludo.
- O LED disseminado (20% dos casos) apresenta lesões acima e abaixo do pescoço e está associado a um risco aumentado de progressão para lúpus eritematoso sistémico.
Lesões Cutâneas:
- Apresentam-se em áreas da face e pescoço expostas ao sol com eritema anelar e hiperqueratose folicular. Foi descrita uma placa característica sobre a área malar da face e ponte do nariz em padrão de borboleta.
- Podem ser acompanhadas de prurido ou sensação de ardor.
- À medida que as lesões progridem, verifica-se a ocorrência de atrofia central, cicatrizes, telangiectasias e hipopigmentação. Pode ainda verificar-se o aparecimento de alopecia cicatricial irreversível no couro cabeludo.
Lesões Orais:
- Registam-se em aproximadamente 20% dos casos e afetam tipicamente os lábios, o palato duro e a mucosa oral.
- Caracterizam-se pela presença de eritema ou ulceração central circundada por pápulas hiperqueratóticas ou estrias radiantes e telangiectasias periféricas (Figuras 1 e 2). O padrão “favo de mel” ocorre em lesões de longa duração.
- As lesões mucosas podem ocorrer sem envolvimento da pele ou antes do desenvolvimento de lesões cutâneas. As lesões labiais podem espalhar-se e envolver a pele adjacente, obscurecendo a borda do limite entre o lábio e a pele.
- Pode também ocorrer gengivite descamativa na gengiva inferior e/ou superior.
- Com a cicatrização, as lesões erosivas podem provocar pigmentação pós-inflamatória.
- Os sintomas mais comuns de LED incluem sensação de ardor, fotossensibilidade, secura, sensibilidade e dor. No entanto, as lesões as lesões podem ser assintomáticas.
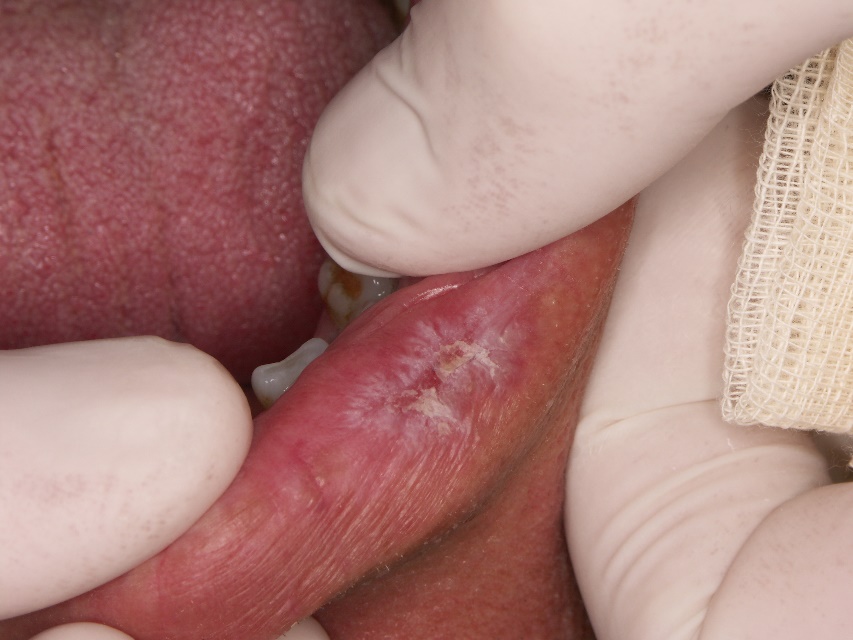
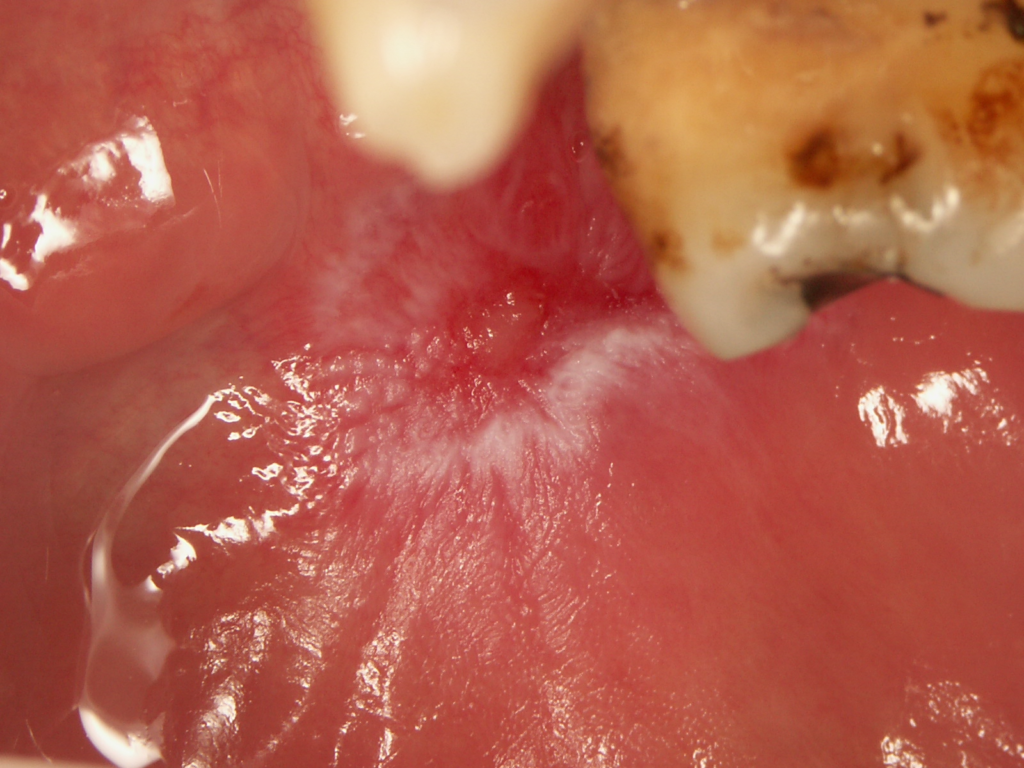
- Pacientes com LED têm risco aumentado de doença oncológica, incluindo cancro da pele não-melanoma e cancro oral, em comparação com a população geral.
- A Organização Mundial da Saúde classificou o LED como uma alteração oral potencialmente maligna, embora a transformação maligna seja rara.
- A transformação maligna ocorre comummente nas lesões de LED localizadas no limite entre o lábio e a pele, sendo o lábio inferior frequentemente mais afetado.
- A exposição prolongada à radiação UV, cicatrizes crónicas, infeção por HPV e terapia imunossupressora a longo prazo podem ser fatores predisponentes para o desenvolvimento de carcinoma de células escamosas. A duração média desde o início do LED até o desenvolvimento do cancro do lábio é menor em comparação com cancros com origem em lesões de LED noutros locais (10 a 13 anos contra 19 a 26 anos).
- Os cancros relacionados com o LED são mais agressivos e têm maior potencial metastático (10-25%), taxas de recorrência (27-29%) e mortalidade (19,4%) em comparação com cancros não relacionados com o LED (20%, 0,5-6% e 1%, respetivamente).
Diagnósticos diferenciais
O diagnóstico diferencial das alterações orais do LED inclui líquen plano oral (LPO), reações liquenoides, leucoplasia oral e quilite actínica (quando o lábio inferior é afetado).
No caso do LPO, as lesões são disseminadas e distribuídas mais simetricamente. O padrão reticular é mais pronunciado, ao contrário das lesões orais provocadas pelo LED.
As reações liquenoides apresentam-se como estrias brancas em locais com contacto direto com a restauração de amálgama. Após a remoção da restauração, a lesão deverá melhorar ou desaparecer por completo.
A leucoplasia oral não apresenta padrão radial de estrias hiperqueratóticas nem atrofia central.
A quilite actínica envolve geralmente o lábio inferior com apresentação de crostas, mas sem formação de estrias.
Diagnóstico
- O diagnóstico de LED pode ser desafiador devido às semelhanças histopatológicas com o líquen plano oral.
- Os resultados histológicos do LED oral incluem hiperqueratose com placas queratóticas, atrofia das cristas interpapilares, degeneração hidrópica da camada basal, mucosite de interface com infiltrado linfocítico perivascular superficial ou profundo, edema na lâmina própria e espessamento PAS-positivo das paredes dos vasos sanguíneos (Figura 3).
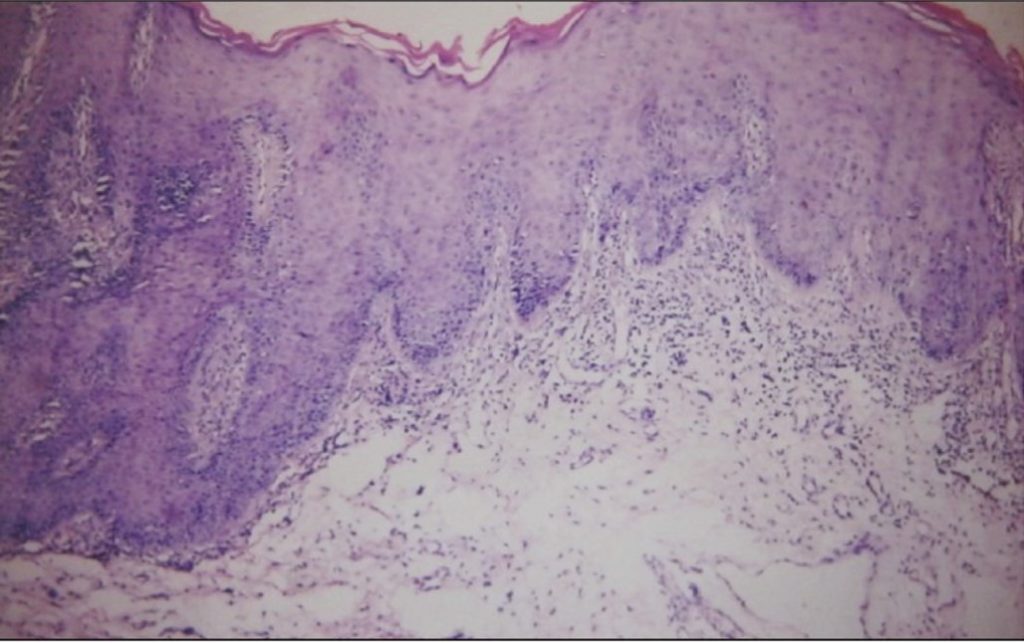
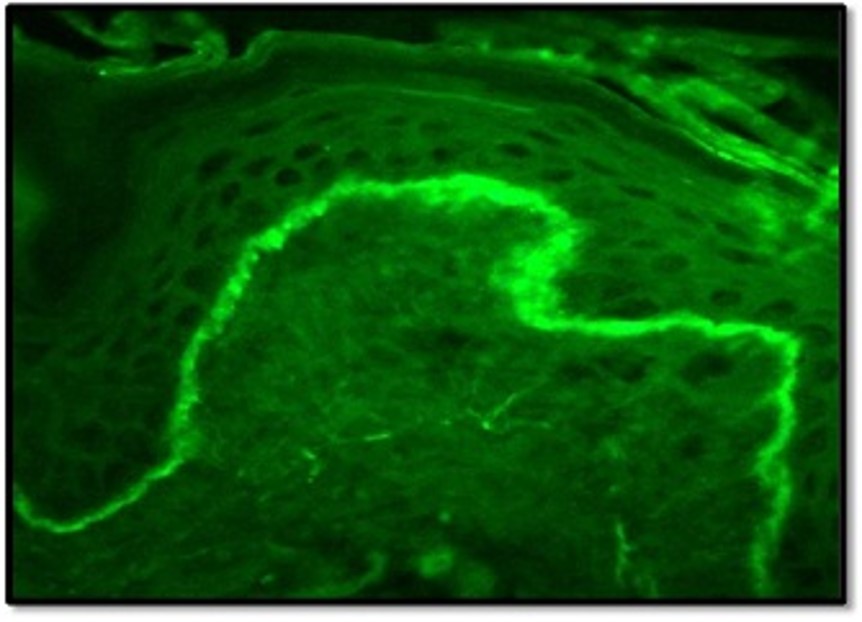
- A imunofluorescência direta (DIF) pode ser útil para análises posteriores. As lesões de LED demonstram deposição linear ou granular de IgM, IgG e complemento 3 (C3) na zona da membrana basal – a “banda de lúpus” (Figura 4).
- Ao contrário do LED, podem ser encontrados depósitos de fibrinogénio ao longo da membrana basal em 90 a 100% ao dos pacientes com LPO. Dada a diferença marcante nos resultados da DIF entre LED e LPO, muitos autores acreditam que a DIF deve fazer parte do padrão diagnóstico quando há suspeita.
- Podem ser detetadas anomalias serológicas e hematológicas em pacientes com LED. Em alguns casos, a velocidade de hemossedimentação pode ser elevada. Aproximadamente 20% dos pacientes têm anticorpos antinucleares (ANA) positivos e até 20% têm autoanticorpos SS-A. Os autoanticorpos anti-Sm, geralmente presentes nos casos de lúpus eritematoso sistémico, podem ocorrer em 5 a 20% dos casos de pacientes com LED.
Tratamento e Prevenção
- Os pacientes devem ser alertados sobre a possibilidade de progressão para doença sistémica. O risco de progressão de LED para LES é de 16,7% nos 3 anos após o primeiro diagnóstico e 17% nos oito anos subsequentes ao diagnóstico. As medidas preventivas incluem evitar a exposição aos raios UV e o abandono de hábitos tabágicos.
- Ainda não há estudos suficientes que documentem o tratamento de LED oral. Existem, porém, registos de utilização de fluocinonida de uso tópico, hidroxicloroquina e acitretina em pacientes com LED cutâneo.
Lesões Orais Localizadas:
- O tratamento tópico é de primeira linha. Os corticosteroides tópicos (acetonido de triancinolona, valerato de betametasona, dipropionato de clobetasol, hidrocortisona, acetonido de fluocinolona) são a base do plano terapêutico.
- Podem ainda ser utilizados inibidores de calcineurina (tacrolimus, pimecrolimus).
- A injeção intra-lesão de corticosteroides (acetonido de triancinolona) é útil no tratamento de lesões individuais.
Lesões recalcitrantes ou doença generalizada
- Muitas vezes é necessário um plano terapêutico sistémico com recurso a, por exemplo, medicamentos antimaláricos (hidroxicloriquina, cloriquina e quinacrina). Estes podem ser prescritos individualmente ou em conjunto com corticosteroides sistémicos, utilizados no tratamento de primeira linha.
- Em casos graves, os imunomodeladores (dapsona, talidomida, lenalidomida) e/ou retinoides orais (acitretina, isotretinoina, alitretinoina) e/ou imunossupressores(metotrexato, azatioprina, ciclofosfamida, micofenolato mofetil, micofenolato de sódio, ciclosporina) podem ser utilizados.
- Agentes biológicos (rituximab, belimumab) são usados nos casos mais graves.
Pacientes com LED devem ser acompanhados em intervalos regulares. A resposta ao tratamento difere para cada paciente, variando de algumas semanas a meses. Cada paciente deve ser tratado caso a caso para fins de controlo de sintomas e vigilância de potencial transformação maligna.
Referências e Literatura Recomendada
Warnakulasurya S. Clinical features and presentation of oral potentially malignant disorders. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:582–90.
Stannard JN, Kahlenberg JN. Cutaneous lupus erythematosus: updates on pathogenesis and associations with systemic lupus. Curr Opin Rheumatol. 2016;28(5): 453–9.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Cutaneous lupus erythematosus and the association with systemic lupus erythematosus: a population-based cohort of 1088 patients in Sweden. Br J Dermatol. 2011;164(6):1335-41.
Blake SC, Daniel BS. Cutaneous lupus erythematosus: A review of the literature. Int J Womens Dermatol. 2019;5(5):320-9.
Szczęch J, Samotij D, Werth DP, Reich A. Trigger factors of cutaneous lupus erythematosus: a review of current literature. Lupus. 2017;26(8):791-807.
Izmirly PM, Buyon JP, Belmont HM, Sahl S, Wan I, Salmon JE et al. Population-based prevalence and incidence estimates of primary discoid lupus erythematosus from the Manhattan Lupus Surveillance Program. Lupus Sci Med. 2019;6(1):e000344.
Jarukitsopa S, Hoganson DDD, Crowson CS, Sokumbi O, Davis MD, Michet CJ et al. Epidemiology of Systemic Lupus Erythematosus and Cutaneous Lupus in a Predominantly White Population in the United States. Arthritis Care Res. 2015; 67(6): 817–28.
Drenkard C, Parker S, Aspey LD, Gordon C, Helmick CG, Bao G, Sam Lim S. Racial disparities in the incidence of primary chronic cutaneous lupus erythematosus in the southeastern US: the Georgia lupus registry. Arthritis Care Res. 2019; 71:95–103.
Nico MMS, Apparecida M, Vileila C, Rivitti EA, Lourenco SV. Oral lesions in lupus erythematosus: correlation with cutaneous lesions. Eur J Dermatol 2008;18(4):376-81.
Menzies S, O’Shea F, Galvin S, Wynne B. Oral manifestations of lupus. Ir J Med Sci. 2018; 187:91–3.
Ranginwala AM, Chalishazar MM, Panja P, Buddhdev KP, Kale HM. Oral discoid lupus erythematosus: A study of twenty-one cases. J Oral Maxillofac Pathol. 2012;16(3): 368–73.
Lallas A, Apalla Z, Lefaki I, et al. Dermoscopy of discoid lupus erythematosus. Br J Dermatol 2013;168: 284–8.
McDaniel B, Sukumaran S,Tanner LS. Discoid Lupus Erythematosus. NCBI Bookshelf. A service of the National Library of Medicine, National Institutes of Health. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-.
Shafer WG, Hine MK, Levy BM. A textbook of oral pathology. 7th ed. Philadelphia: W B Saunders;1999. p. 8992.
Kranti K, Seshan H, Juliet J. Discoid lupus erythematosus involving gingiva. J Indian Soc Periodontol. 2012;16(1): 126–8.
Grönhagen CM, Fored CM, Granath F, Nyberg F. Increased risk of cancer among 3663 patients with cutaneous lupus erythematosus: A Swedish nationwide cohort study. Br J Dermatol 2012; 166: 1053–1059.
de Berker D, Dissaneyeka M, Burge S. The sequelae of chronic cutaneous lupus erythematosus. Lupus 1992;1:181-6.
Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-580.
Arvanitidou IE, Nikitakis NG, Georgaki M, Papadogeorgakis N, Tzioufas A, Sklavounou A. Multiple primary squamous cell carcinomas of the lower lip and tongue arising in discoid lupus erythematosus: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol. 2018;125:e22-e30.
Fernandes MS, Girisha BS, Viswanathan N, Sripathi H and Noronha TM. Discoid lupus erythematosus with squamous cell carcinoma: a case report and review of the literature in Indian patients. Lupus. 2015; 24: 1562–6.
Sherman RN, Lee CW, Flynn KJ. Cutaneous squamous cell carcinoma in black patients with chronic discoid lupus erythematosus. Int J Dermatol 1993; 32: 677–679.
Liu W, Shen ZY, Wang LJ, et al. Malignant potential of oral and labial chronic discoid lupus erythematosus: A clinicopathological study of 87 cases. Histopathology 2011; 59: 292–298.
Tao J, Zhang X, Guo N, et al. Squamous cell carcinoma complicating discoid lupus erythematosus in Chinese patients: Review of the literature, 1964–2010. J Am Dermatol 2012; 66: 695–696.
Makita E, Akasaka E, Sakuraba Y, Korekawa A, Aizu T, Kaneko T et al. Squamous cell carcinoma on the lip arising from discoid lupus erythematosus: a case report and review of Japanese patients. Eur J Dermatol. 2016;26(4):395-6.
Naik V, Prakash S. Oral Discoid Lupus Erythematosus: A Case Effectively Managed and Differentiated with other Overlapping Diseases. Indian J Dent Adv 2018;9(4): 221-5.
Del Barrio‐Díaz P, Reyes‐Vivanco C, Cifuentes‐Mutinelli M, Manríquez J, Vera‐Kellet C. Association between oral lesions and disease activity in lupus erythematosus. J Eur Acad Dermatol Venereol. 2020;34(2):349-356.
Martins da Costa Marques ER, Silva R, Hsieh R. Oral Mucosal Manifestation of Lupus Erythematosus: A Short Review. DOBCR. doi: 10.31487/j.DOBCR.2020.02.09
Bhushan R, Agarwal S, Chander R, Agarwal K. Direct Immunofluorescence Study in Discoid Lupus Erythematosus. World Journal of Pathology 2017; 9:56-60.
Biazar C. Sigges J. Patsinakidis N. Ruland V. Amler S. Bonsmann G. Kuhn A. Cutaneous lupus erythematosus: first multicenter database analysis of 1002 patients from the European Society of Cutaneous Lupus Erythematosus (EUSCLE).Autoimmun Rev. 2013; 12(3):444-454.
Wieczorek I.T., Propert K.J., Okawa J, Werth V.P. Systemic symptoms in the progression of cutaneous to systemic lupus erythematosus. JAMA Dermatol. 2014; 150(3):291-6.
Jessop S, Whitelaw DA, Grainge MJ, Jayasekera P. Drugs for discoid lupus erythematosus. Cochrane Database Syst Rev. 2017;5(5):CD002954.
Okon LG, Werth VP. Cutaneous lupus erythematosus: diagnosis and treatment. Best Pract Res Clin Rheumatol. 2013;27: 391-404.







