A Fibrose Submucosa Oral (FSO) é uma condição cicatricial crónica e progressiva que afeta a mucosa orofaríngea e, muitas vezes, o esófago superior.
Não existe uma definição universalmente aceite para a FSO, embora as definições mais recentes forneçam informação sobre a etiologia, epidemiologia e características clínicas da doença. Em 1966, Pindborg definiu a FSO como “uma doença crónica, insidiosa, que afeta qualquer parte da cavidade oral e por vezes a faringe”. Brad (2019) definiu a FSO como uma “condição crónica, pré-cancerosa e muitas vezes debilitante caracterizada por fibrose lentamente progressiva da cavidade oral e orofaringe”. Langdon (2007) descreve-a como “uma doença progressiva na qual bandas fibrosas se formam sob a mucosa oral”.
Etiopatogenia
A etiologia da FSO é multifatorial.
- Noz-de-areca ou avelã-da-índia é o nome dado ao fruto da arequeira.
- Observa-se uma relação dependente tanto da quantidade quanto da frequência e da duração da mastigação no desenvolvimento da FSO.
- Mascar noz-de-areca, bétele ou “paan” é um hábito recreativo no subcontinente indiano. Devido à migração, o seu consumo torna-se cada vez mais comum nas comunidades ocidentais.
- Certas preparações de noz-de-areca incluem tabaco e outros agentes cancerígenos conhecidos. A noz-de-areca isoladamente é um carcinógeno reconhecido, pois contém certos taninos e alcalóides que possuem citotoxicidade e genotoxicidade. A cal apagada, que é outro ingrediente comum nas preparações de noz-de-areca, tem elevadas concentrações de arsénio.
- No hinduísmo, a noz-de-areca é associada a qualidades divinas e é consumida devido ao valor medicinal percecionado. Também foi visto como um afrodisíaco, um agente que melhora a higiene oral e reduz a halitose, um estimulante salivar que melhora a digestão e, no subcontinente indiano, acredita-se que tenha um efeito estabilizador no controlo glicémico em pacientes com diabetes.
- A arceína, subproduto resultante do metabolismo da noz-de-areca, é um alcaloide que facilmente atravessa a barreira hematoencefálica e tem sido implicado no potencial viciante do hábito de mascar noz-de-areca. Os efeitos fisiológicos subsequentes são frequentemente descritos como eufóricos, sendo também descrita uma consciencialização e produtividade aprimoradas.
- Mascar noz-de-areca tem sido indicado como fator etiológico no desenvolvimento da FSO. A Agência Internacional de Pesquisa sobre Cancro (IARC) classificou a noz-de-areca como cancerígena do Grupo 1.
- Outros fatores etiológicos relatados incluem hábito tabágico pré-existente (sem fumo), deficiências hemáticas, anemia e subnutrição.
- Pode também existir predisposição genética, com associação com certos subtipos e haplótipos HLA (A10/DR3).
- A subnutrição, anemia e deficiências hemáticas estão associadas à atrofia da mucosa oral e aumento potencial da síntese de colagénio.
Mascar avelã-da-índia é o principal fator de risco etiológico no desenvolvimento de FSO e os fatores acima podem ser vistos como contributivos.
Histopatologia
- A FSO caracteriza-se pela deposição anormal de colagénio.
- Os alcaloides da noz-de-areca, como a arceína, causam a proliferação de fibroblastos. Os aromatizantes existentes em preparações de noz-de-areca, como os taninos, podem também inibir a atividade da colagenase.
- A progressão da doença está associada à substituição do colagénio tipo 1, facilmente degradável, por colagénio tipo 3 mais resistente. Existe também inibição da fagocitose do colagénio.
- Amostras histopatológicas exibirão certas características de FSO, como atrofia ou enfraquecimento do epitélio e hialinização justa-epitelial e colagénio de densidade variável, juntamente com fibrose da lâmina própria e fibrilhas de ancoragem.
Epidemiologia
A FSO ocorre predominantemente no subcontinente indiano e no Sudeste Asiático, incluindo a Índia, Taiwan, China, Bangladesh, Malásia, Singapura, Tailândia e Sri Lanka. Também foi relatado na África do Sul e na Arábia Saudita. A FSO é encontrada em populações asiáticas nos EUA, Reino Unido e países desenvolvidos e, portanto, a condição representa um problema para a saúde global. O número de casos globais em 1996 foi estimado em 2,5 milhões. A prevalência na Índia foi relatada como sendo tão alta quanto 30%. Globalmente, o consumo de noz de Areca foi relatado como sendo tão alto quanto 5-20%. Os sintomas da FSO tendem a desenvolver-se entre as 4ª e 5ª décadas de vida, mas foram relatados casos em pacientes tão jovens quanto onze anos. A doença tem uma preponderância feminina por razões desconhecidas.
Manifestações Clínicas
- More (2012) categoriza clinicamente a FSO em quatro estádios, abrangendo primeiramente uma fase eruptiva e depois uma fase fibrótica.
- A fase eruptiva pode estar associada à formação de vesículas, sendo comum a sensação de ardor e desconforto na cavidade oral. A textura da mucosa oral começa a mudar, perdendo a sua flexibilidade. A palidez da mucosa progride e começa a branquear. Petéquias mucosas podem desenvolver-se, assim como pigmentação melanótica da mucosa, ulceração e áreas eritematosas.
- No estádio II, ocorre fibrose nas vesículas e nas úlceras quando cicatrizam. Desenvolvem-se bandas fibrosas palpáveis verticais e circulares na mucosa oral e/ou orofaringe, com ou sem estomatite. Nos estádios iniciais, podem estar presentes bandas mais finas, quando comparadas a essas bandas palpáveis.
- No estádio III, podem estar presentes bandas fibrosas palpáveis em qualquer parte da cavidade oral, com ou sem estomatite. O estádio IV engloba todos os fatores acima, acrescendo o desenvolvimento de uma alteração potencialmente maligna ou um distinto carcinoma de células escamosas oral.
- AS características específicas dos estádios II a IV incluem trismo, despigmentação da gengiva, úvula atrófica e despapilação da língua. Podem também ser observadas alterações na estética facial, como as bochechas afuniladas, sem correlação com a idade ou estado nutricional.
- Em casos mais graves, podem ainda desenvolver-se défices na fala e na audição. A FSO tem sido relatada como tendo um impacto significativo na qualidade de vida em estádios mais avançados.
- More também descreveu um estadiamento funcional da FSO baseado na abertura inter-incisiva da boca: Estádio I (maior ou igual a 35mm), Estádio II (entre 25 e 35mm), Estádio III (15 e 25mm) e Estádio IV (menor que 15mm).
- Paymaster relatou pela primeira vez o potencial pré-maligno da FSO em 1956.
- Existem variações geográficas significativas nas taxas de transformação maligna relatadas sendo geralmente maior na Índia, quando comparada a outros países.
- Uma possível explicação é a forma como a noz-de-areca é preparada com aditivos. Estudos de Taiwan descobriram que os produtos de tabaco geralmente não são utilizados em conjunto com produtos de noz-de-areca, podendo explicar a menor taxa de transformação maligna nessa população.
- A taxa de transformação maligna foi estimada entre 1 e 9%.
- Uma maior taxa de transformação maligna foi observada nos indivíduos com leucoplasia oral concomitante.
- Os cancros orais com origem na FSO também foram relatados como menos e mais agressivos quando comparados ao cancro oral originado de outras lesões na cavidade oral.
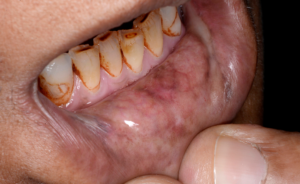
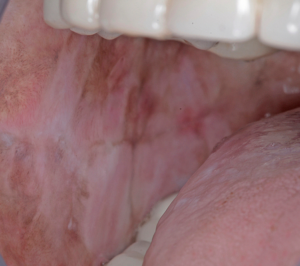
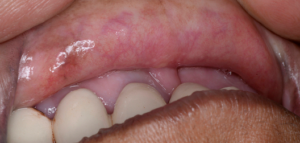
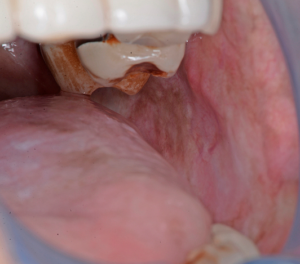
Diagnóstico Diferencial
Nos estádios iniciais, a FSO pode ser mal diagnosticada. Pacientes que apresentem queixas de sensação de ardor com atrofia da mucosa podem ser diagnosticados com Disestesia Oral, com ou sem um fator contribuinte subjacente, como deficiência hemática ou anemia. A anamnese cuidadosa e a investigação dos hábitos recreativos são fundamentais. Pode ainda apresentar características semelhantes a outras alterações orais potencialmente malignas, como o líquen plano oral.
A esclerodermia é uma condição autoimune que afeta a pele, órgãos internos e vasos sanguíneos e é caracterizada por esclerose difusa da pele e outros tecidos conjuntivos. A esclerodermia pode apresentar-se com bandas fibrosas na mucosa oral e trismo progressivo. Pacientes com esclerodermia também apresentarão sintomas extra-orais. Imagens microvasculares e testes de autoanticorpos ajudam a estabelecer o diagnóstico de esclerodermia.
A amiloidose é caracterizada pela deposição de proteínas amiloides (proteína fibrilhar) nos tecidos. A amiloidose sistémica pode apresentar macroglossia ou trismo progressivo. Uma anamnese cuidada, análises ao sangue e a biópsia ajudam a estabelecer o diagnóstico.
Nos estádios mais avançados, a FSO pode apresentar-se como cancro das células escamosas oral, leucoplasia e eritroplasia.
Diagnóstico
- Uma investigação cuidadosa sobre hábitos recreativos será um bom indicador para estabelecer o diagnóstico de FSO. Sendo esta uma alteração potencialmente maligna, será necessária uma biópsia incisional.
- A análise histopatológica é útil na identificação do estádio clínico da doença, em que a distribuição e número de fibroblastos, fibras de colagénio, presença e número de células inflamatórias e vasos sanguíneos estão correlacionados com o grau da doença.
- O trauma do procedimento de biópsia induz um grau de fibrose que pode contribuir para o agravamento do trismo.
- Certos biomarcadores, como o mRNA, podem influenciar o estádio da doença e a análise genética de espécimes pode prever futuras transformações malignas.
- A técnica de coloração principal utilizada no diagnóstico de FSO é a hematoxilina e eosina.
Tratamento e Prevenção
Os pacientes devem ser informados sobre os perigos associados ao hábito contínuo de mascar noz-de-areca, o seu papel na etiopatogenia e o risco de transformação maligna, devendo ser encorajados a abandoná-lo. A FSO pressupõe uma carga global significativa de doenças e a prevenção primária é um ponto-chave da estratégia dos governos em países do subcontinente indiano. Abordagens como a proibição de produtos vegetais da Areca e as suas preparações e ações educativas sobre os efeitos nocivos de mascar noz-de-areca demonstraram ser úteis na prevenção primária a níveis individuais e comunitários. A FSO manifesta-se geralmente tarde, o que se traduz num dilema no tratamento.
» Terapêutica de Manutenção
Terapêutica de manutenção
- Nos estádios moderados a graves da FSO, o grau de fibrose é irreversível e o tratamento é principalmente sintomático.
- A terapêutica de manutenção para a redução progressiva da abertura da boca envolve fisioterapia. Aconselha-se a prática de vários exercícios que visam alongar os tecidos e fortalecer os músculos da mastigação. Os dispositivos feitos sob medida também podem ser úteis na redução do trismo, sendo os pacientes encorajados a massajar estes músculos. A higiene oral deve ser reforçada, uma vez que os pacientes com FSO apresentam níveis mais elevados de doenças dentárias, como doença periodontal, cárie dentária e halitose.
- Pacientes com queixas de desconforto geral oral podem receber prescrição de anestésicos. Em estádios mais avançados da FSO, as injeções intralesionais de corticosteróides têm sido úteis na redução do trismo.
» Ver menos
» Tratamento Cirúrgico
Tratamento Cirúrgico
- O tratamento cirúrgico pode ser indicado em casos graves de trismo e visa melhorar a abertura da boca e a saúde mastigatória e oral.
- A abordagem cirúrgica geralmente envolve a remoção do tecido fibrótico e os cuidados subsequentes visam a manutenção da abertura após a remoção e libertação do músculo.
- A simples excisão das bandas fibróticas agrava a condição, pois o trauma iatrogénico do processo cirúrgico leva a fibrose subsequente.
- O trismo crónico enquanto consequência da FSO pode levar a alterações fisiológicas no tendão temporal e os procedimentos de enxerto de pele podem ajudar a resolvê-lo. Por exemplo, um enxerto de pele de espessura parcial após miotomia temporal bilateral ou coronoidectomia. Estas intervenções cirúrgicas são extensas e não devem ser consideradas levianamente; contudo, poderão aliviar a sintomatologia do trismo.
- Também pode ser considerada miotomia de outros músculos mastigatórios.
» Ver menos
Síntese
A Fibrose Submucosa Oral é uma condição crónica e progressiva que resulta em fibrose da mucosa orofaríngea e, ocasionalmente, do esófago superior, como resultado de alterações fisiológicas induzidas por mascar noz-de-areca. Este fruto e os seus metabólitos são cancerígenos e várias preparações incluem outros carcinogéneos. A taxa de transformação maligna varia geograficamente entre 1 a 9%. A taxa de transformação maligna depende da dose ingerida e está correlacionada com a duração e intensidade do hábito de mascar noz-de-areca, quando aliada ao consumo de álcool e tabaco. Não existe nenhum plano de tratamento universalmente aceite.
De modo geral, o conhecimento desta condição entre a população em geral e os profissionais de saúde é baixo, o que pode contribuir para um diagnóstico tardio. Todos os profissionais de saúde têm um papel na prevenção primária e reconhecimento da doença.
Read more
J.D. Langdon, in Oral and Maxillofacial Surgery (Second Edition), 2007
Brad W. Neville DDS, … Angela C. Chi DMD, in Color Atlas of Oral and Maxillofacial Diseases, 2019
Raman Bedi, Crispian Scully, in Manson’s Tropical Infectious Diseases (Twenty-third Edition), 2014
More C, Gupta S, Joshi J, Varma S. Classification system of Oral submucous fibrosis. J Indian Acad Oral Med Radiol. 2012;24(1):24–9
Ali, F. M., Patil, A., Patil, K. and Prasant, M. C. (2014) ‘Oral submucous fibrosis and its dermatological relation’, Indian Dermatol Online J, 5(3), pp. 260-5.
Angadi, P. V. and Rao, S. S. (2011) ‘Areca nut in pathogenesis of oral submucous fibrosis: revisited’, Oral Maxillofac Surg, 15(1), pp. 1-9.
Arakeri, G., Patil, S. G., Aljabab, A. S., Lin, K. C., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017a) ‘Oral submucous fibrosis: An update on pathophysiology of malignant transformation’, J Oral Pathol Med, 46(6), pp. 413-417.
Arakeri, G., Rai, K. K., Boraks, G., Patil, S. G., Aljabab, A. S., Merkx, M. A. W., Carrozzo, M. and Brennan, P. A. (2017b) ‘Current protocols in the management of oral submucous fibrosis: An update’, J Oral Pathol Med, 46(6), pp. 418-423.
Arakeri, G., Rai, K. K., Hunasgi, S., Merkx, M. A. W., Gao, S. and Brennan, P. A. (2017c) ‘Oral submucous fibrosis: An update on current theories of pathogenesis’, J Oral Pathol Med, 46(6), pp. 406-412.
Cox, S. C. and Walker, D. M. (1996) ‘Oral submucous fibrosis. A review’, Aust Dent J, 41(5), pp. 294-9.
Garg, A., Chaturvedi, P. and Gupta, P. C. (2014) ‘A review of the systemic adverse effects of areca nut or betel nut’, Indian J Med Paediatr Oncol, 35(1), pp. 3-9.
Gupta, P. C. and Warnakulasuriya, S. (2002) ‘Global epidemiology of areca nut usage’, Addict Biol, 7(1), pp. 77-83.
Kim, D. H., Lee, J., Lee, M. H., Kim, S. W. and Hwang, S. H. (2020) ‘Efficacy of chemiluminescence in the diagnosis and screening of oral cancer and precancer: a systematic review and meta-analysis’, Braz J Otorhinolaryngol.
Murti, P. R., Bhonsle, R. B., Pindborg, J. J., Daftary, D. K., Gupta, P. C. and Mehta, F. S. (1985) ‘Malignant transformation rate in oral submucous fibrosis over a 17-year period’, Community Dent Oral Epidemiol, 13(6), pp. 340-1.
Pandya, S., Chaudhary, A. K., Singh, M. and Mehrotra, R. (2009) ‘Correlation of histopathological diagnosis with habits and clinical findings in oral submucous fibrosis’, Head Neck Oncol, 1, pp. 10.
Passi, D., Bhanot, P., Kacker, D., Chahal, D., Atri, M. and Panwar, Y. (2017) ‘Oral submucous fibrosis: Newer proposed classification with critical updates in pathogenesis and management strategies’, Natl J Maxillofac Surg, 8(2), pp. 89-94.
PAYMASTER, J. C. (1956) ‘Cancer of the buccal mucosa; a clinical study of 650 cases in Indian patients’, Cancer, 9(3), pp. 431-5.
Pindborg, J. J. and Sirsat, S. M. (1966) ‘Oral submucous fibrosis’, Oral Surg Oral Med Oral Pathol, 22(6), pp. 764-79.
Rai, A., Ahmad, T., Parveen, S., Faizan, M. I. and Ali, S. (2020) ‘Expression of transforming growth factor beta in oral submucous fibrosis’, J Oral Biol Craniofac Res, 10(2), pp. 166-170.
Rai, S., Rattan, V., Gupta, A. and Kumar, P. (2018) ‘Conservative management of Oral Submucous Fibrosis in early and intermediate stage’, J Oral Biol Craniofac Res, 8(2), pp. 86-88.
Rajendran, R. (1994) ‘Oral submucous fibrosis: etiology, pathogenesis, and future research’, Bull World Health Organ, 72(6), pp. 985-96.
Rao, N. R., Villa, A., More, C. B., Jayasinghe, R. D., Kerr, A. R. and Johnson, N. W. (2020) ‘Oral submucous fibrosis: a contemporary narrative review with a proposed inter-professional approach for an early diagnosis and clinical management’, J Otolaryngol Head Neck Surg, 49(1), pp. 3.
Shih, Y. H., Wang, T. H., Shieh, T. M. and Tseng, Y. H. (2019) ‘Oral Submucous Fibrosis: A Review on Etiopathogenesis, Diagnosis, and Therapy’, Int J Mol Sci, 20(12).
Silva, W. P., Wastner, B. F., Bohn, J. C., Jung, J. E., Schussel, J. L. and Sassi, L. M. (2015) ‘Unusual presentation of oral amyloidosis’, Contemp Clin Dent, 6(Suppl 1), pp. S282-4.
Yoithapprabhunath, T. R., Maheswaran, T., Dineshshankar, J., Anusushanth, A., Sindhuja, P. and Sitra, G. (2013) ‘Pathogenesis and therapeutic intervention of oral submucous fibrosis’, J Pharm Bioallied Sci, 5(Suppl 1), pp. S85-8.







